Введение
В настоящее время краниотомия в ветеринарной медицине не является чем-то сверхъестественным и невозможным: с развитием нейрохирургии операции на головном мозге проводятся во многих городах России и Беларуси. Рутинно для обезболивания пациентов в ходе интракраниальной хирургии и после нее используются системные анальгетики, однако все они обладают побочными эффектами, которые могут привести к ухудшению состояния пациентов и последующему длительному восстановлению в отделении реанимации и интенсивной терапии. Помимо этого, врачи большинства ветеринарных клиник не могут использовать наркотические средства ввиду отсутствия лицензии на их применение, что также является препятствием для выполнения большинства нейрохирургических операций.В данной статье описаны методы регионарной анестезии, которые позволяют минимизировать использование системных анальгетиков при проведении операций на головном мозге. К ним относятся блокады лобного, скуловисочного, большого затылочного и тройничного нервов.
Контроль боли в интракраниальной нейрохирургии
Для контроля боли в анестезиологии рекомендовано использовать мультимодальную концепцию анальгезии, которая подразумевает одновременное применение нескольких системных анальгетиков и/или методов анальгезии, обладающих различными механизмами действия и оказывающих синергический эффект. Однако при использовании большинства анальгетиков существует риск возникновения различных побочных эффектов (например, при введении опиоидов могут наблюдаться рвота, респираторная депрессия и гиперкапния, которые могут приводить к увеличению внутричерепного давления, а также снижению моторики ЖКТ)2,5. Помимо этого, применение опиоидов влечет за собой снижение уровня сознания, что затрудняет оценку ментального статуса пациента2,5. Использование нестероидных противовоспалительных препаратов (НПВП) может привести к снижению агрегации тромбоцитов, что негативно влияет на гемостаз, повышая риск развития острой послеоперационной внутричерепной гематомы2,5. Для пациентов после нейрохирургических операций эти побочные эффекты могут стать критическими и привести к ухудшению общего состояния и длительной госпитализации.В сравнении с абдоминальными и торакальными вмешательствами операции на головном мозге (ГМ) не сопровождаются возникновением болевого синдрома высокой степени тяжести. Это связано с тем, что в мозговой ткани нет чувствительных нервных волокон, поэтому действия непосредственно на самом головном мозге не могут быть болезненными. При таких операциях боль возникает при травматизации кожи, кости, твердой мозговой оболочки (ТМО). Все реакции сердечно-сосудистой системы после окончания доступа к головному мозгу вегетативные, то есть опосредованы рефлексами, а не болью, и не требуют коррекции с помощью анальгетиков. Для адекватной анальгезии при проведении краниотомий необходимо обеспечить прерывание прохождения болевого импульса на этапе трансдукции и трансмиссии во время проведения доступа к ГМ и закрытия послеоперационного дефекта; этот эффект может быть достигнут при использовании регионарной анестезии2.
В медицине человека толчком к развитию регионарной анестезии в нейрохирургии послужила необходимость проведения краниотомии в сознании3. В ветеринарной медицине нет возможности проводить краниотомию с сохранением сознания пациента, однако проблемы, связанные с побочными действиями препаратов для анальгезии, также приводят к необходимости развития регионарной анестезии в нейрохирургии. Применение блокад в области головы позволяет обеспечить эффективный контроль болевого синдрома во время и после хирургических вмешательств без использования системных анальгетиков (или с их минимальным количеством), а значит, минимизировать риск ухудшения состояния из-за побочных эффектов данных препаратов.
Основные аспекты использования регионарной анестезии
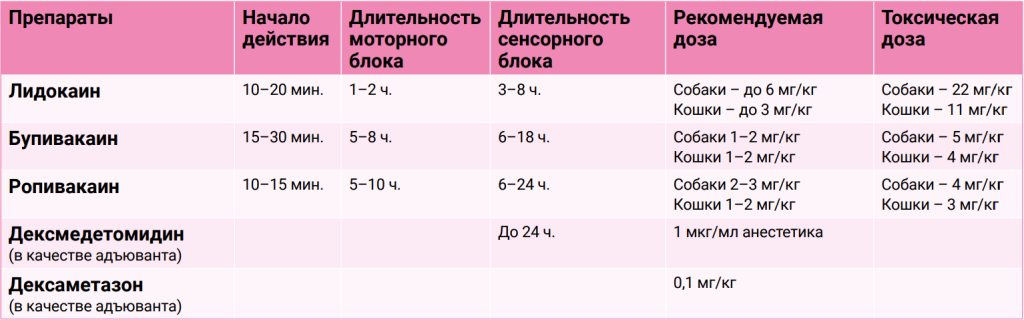
Местные анестетики, взаимодействуя с натриевыми каналами, блокируют их активность и препятствуют проникновению ионов натрия в аксоны нервных клеток, тем самым уменьшая скорость деполяризации. В результате этого блокируется нервная проводимость на этапе трансмиссии5. Предпочтительнее использовать местные анестетики с длительным периодом действия, например, бупивакаин и ропивакаин2. Для пролонгирования эффекта анестетиков допускается применение адъювантных препаратов, таких как дексмедетомидин и дексаметазон (табл. 1)6,8. Применение данных препаратов в рекомендованных дозировках не вызывает значительных изменений в гемодинамике пациента во время операции, обеспечивая при этом адекватный уровень анальгезии на протяжении 12–24 ч. и предотвращая возникновение болевого синдрома в раннем послеоперационном периоде.Для анальгезии в раннем послеоперационном периоде в качестве дополнения к регионарной анестезии можно использовать парацетамол и метамизол натрия. Данные препараты ингибируют ЦОГ-3 и снижают синтез простагландинов, также они конъюгируют с арахидоновой кислотой, образуя метаболиты, которые активируют эндогенные каннабиноидные рецепторы и, взаимодействуя с ними, оказывают анальгетическое действие. Парацетамол и метамизол натрия можно использовать в комбинации со стероидными противовоспалительными препаратами. Следует учитывать, что применение парацетамола у кошек противопоказано из-за его токсичности, обусловленной повышенной чувствительностью эритроцитов и гепатоцитов этих животных к пероксидам5,10.
В медицине человека существуют исследования, указывающие на возможность использования блокад в области головы не только для анальгезии кожи, но и для обезболивания мышц и близлежащей кости3,9. В ветеринарной медицине отсутствуют литературные данные о снижении активности сенсорной иннервации более глубоких структур, однако, исходя из клинического опыта автора, данные блокады могут применяться в сочетании с инфильтрационной и аппликационной анестезией (нанесение местных анестетиков на ТМО), при этом введения системных анальгетиков не требуется. При необходимости можно использовать опиоиды короткого действия, такие как фентанил или ремифентанил.
Осложнения, которые могут возникнуть при использовании регионарной анестезии:
- Ятрогенное повреждение нерва: данное осложнение возникает при непосредственном механическом повреждении нерва иглой или вследствие сдавливания нерва значительным объемом анестетика, введенного с высокой скоростью5,6. При проведении блокад необходимо использовать атравматичные иглы со срезом 45–60° и вводить необходимый объем анестетика в течение 30–40 сек.
- Передозировка и токсические эффекты местных анестетиков. При использовании данных препаратов крайне важно соблюдать максимально допустимую дозу, рассчитанную исходя из идеальной массы тела пациента. Превышение рекомендуемой дозировки может привести к развитию системных побочных эффектов (судороги, кома, гипотензия, сердечно-сосудистый коллапс)5,6. В случае необходимости для увеличения объема местного анестетика допустимо добавлять к нему физиологический раствор или воду для инъекций.
- Внутрисосудистое введение. Местные анестетики обладают кардиотоксическим эффектом и при введении в сосуд могут вызывать нарушения гемодинамики, которые проявляются нарушениями ритма (тахикардия, брадикардия вплоть до асистолии, желудочковые нарушения ритма, переходящие в фибрилляцию желудочков), а также развитие сердечно-сосудистого коллапса, обусловленного нарушением сократительной функции миокарда5,6. Перед введением анестетика проводят аспирационную пробу: при наличии крови в игле необходимо прекратить введение препарата и выполнить пункцию заново.
Для увеличения эффективности проводимых мероприятий необходимо использовать жировые эмульсии. Механизм действия эмульсий заключается в связывании молекул местного анестетика с липидами, в результате чего их концентрация в плазме снижается; часть молекул, зафиксированных на цитоплазматической мембране кардиомиоцитов, отсоединяется от нее за счет градиента концентраций и переходит в плазму крови, где происходит их дальнейшее связывание с липидами. Кроме того, липиды служат энергетическим субстратом для митохондрий кардиомиоцитов, способствуя восстановлению синтеза АТФ. Для «липидного спасения» используется 20%-ный раствор липидов по следующей схеме: болюс – 1,5 мл/кг, далее ИПС – 0,25 мл/кг/мин в течение 30–60 мин.6
Блокада лобного нерва
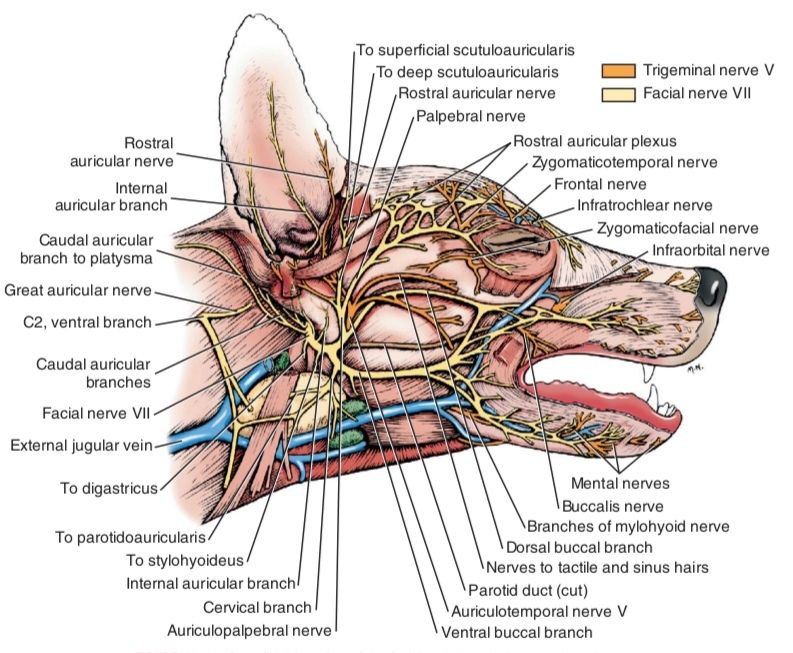
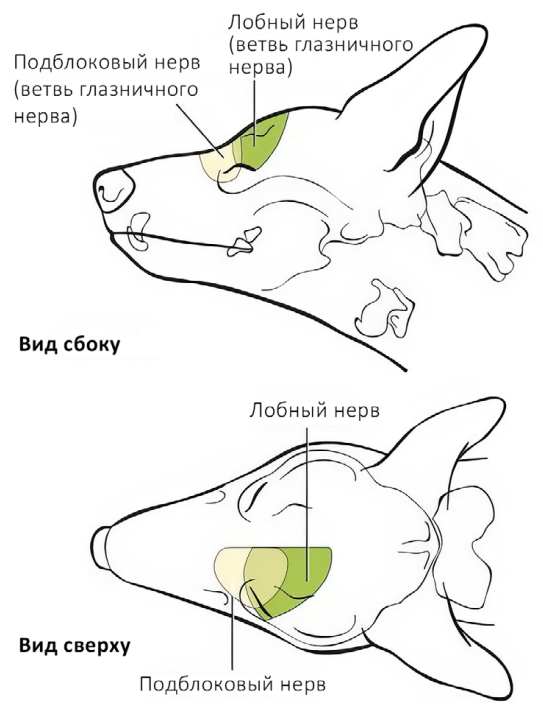
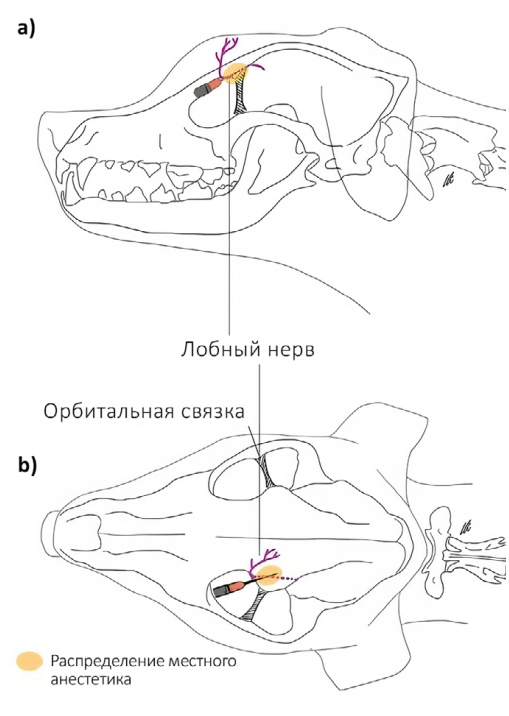
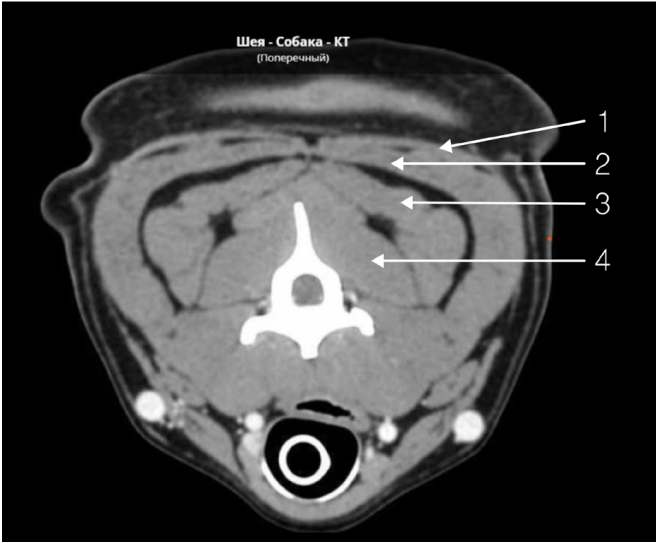
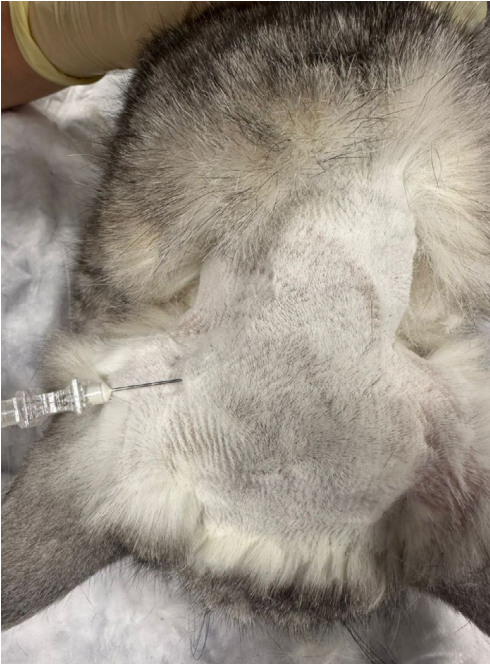
Лобный нерв (n. frontalis) отходит от глазничного нерва и является ветвью тройничного нерва. Он обеспечивает чувствительную иннервацию кожи лба от дорсального края глазницы до средней линии головы, а также конъюнктивы и кожи верхнего века (рис. 1, 2)4,7. Рядом с ним проходят дорсальная наружная глазничная вена и латеральная артерия верхнего века4. Блокаду можно проводить по методу анатомических ориентиров или с использованием УЗИ-навигации для минимизации риска пункции сосудов и визуализации глазного яблока.Техника проведения. Пальпаторно определяется место пункции – углубление на глазничной части лобной кости, расположенное дорсально от связки орбиты. Игла вводится перпендикулярно поверхности кожи, после чего ее продвигают вглубь тканей под углом 45–60° до надкостницы по дорсальному краю глазницы непосредственно над орбитой, минуя глазное яблоко (рис. 3, 4)4.
Доза: 0,04 мл/кг анестетика. Половина объема вводится на максимальной глубине, половина – при извлечении иглы. Раствор вводится в течение 30–40 сек. без усилия для более равномерного распределения анестетика4.
Блокада скуловисочного нерва
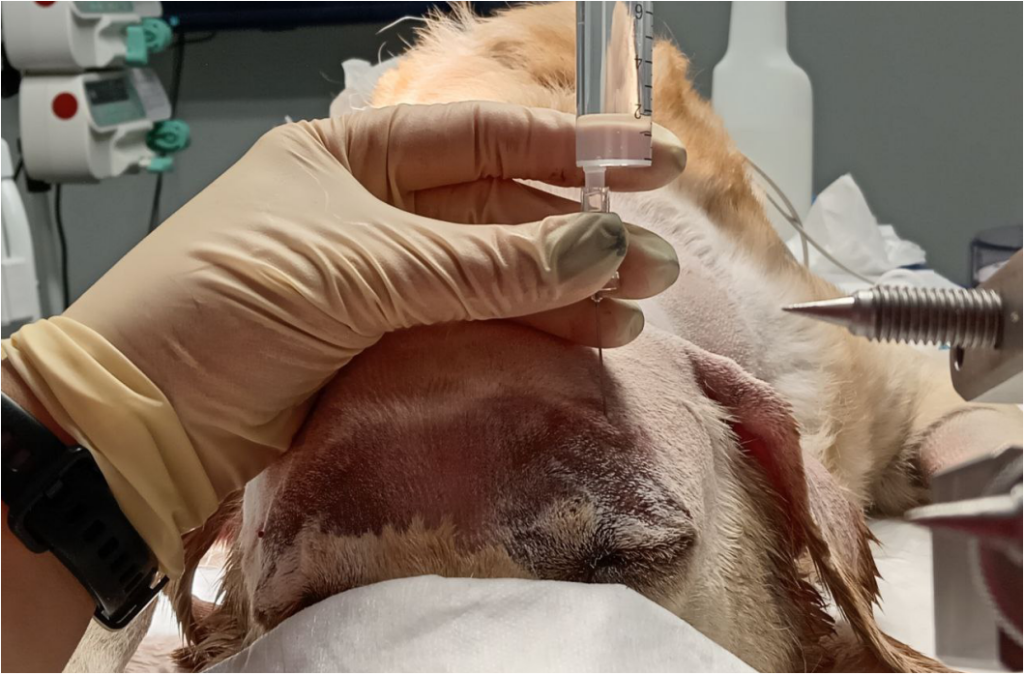
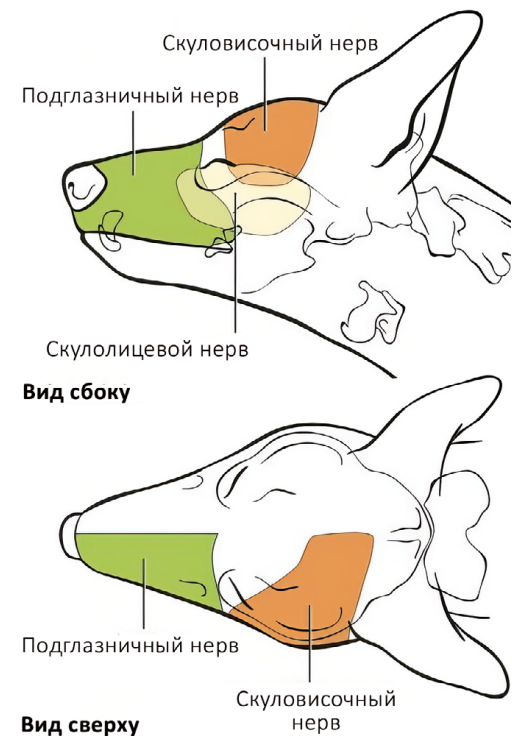
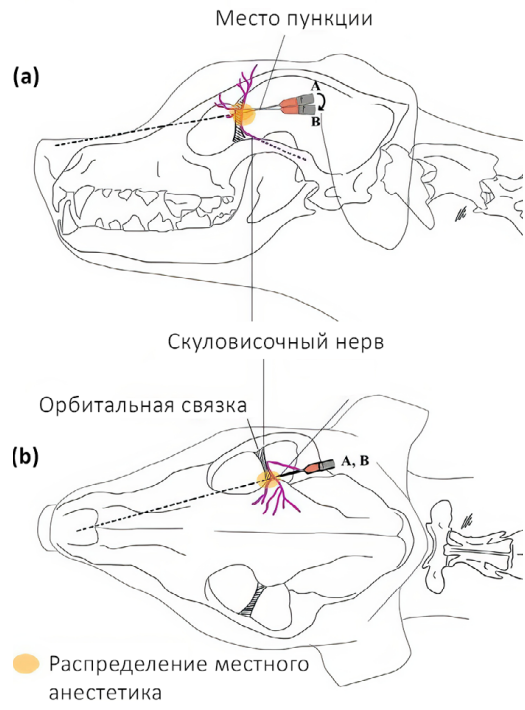
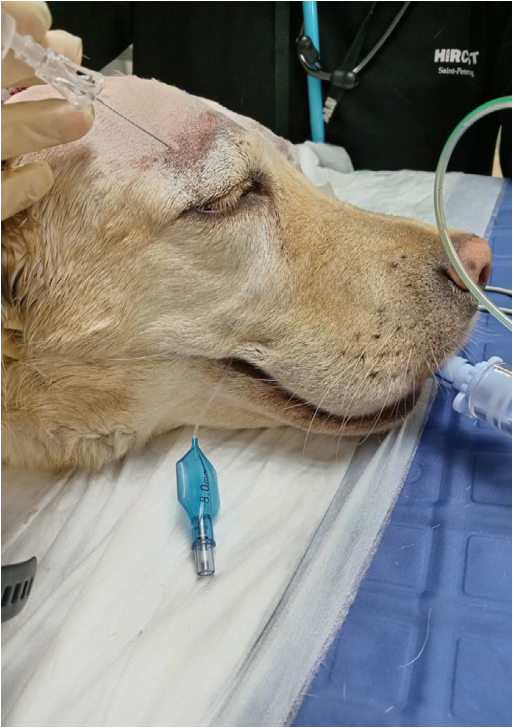
Скуловисочный нерв (n. zygomaticotemporalis) является ветвью тройничного нерва и отходит от верхнечелюстного нерва. Он обеспечивает чувствительную иннервацию височной области, расположенной дорсальнее скуловой дуги, вплоть до средней линии головы (рис. 1, 5)4,7. В процессе проведения данной блокады существует вероятность одномоментного блока слезного, отводящего, блокового и глазодвигательного нервов вследствие их близкого расположения. Это может привести к акинезии глазного яблока и расширению зрачков. Данные эффекты являются обратимыми и прекращаются после окончания моторного блока анестетика. Блокада выполняется с использованием метода анатомических ориентиров.Техника проведения. Пальпаторно определяется место пункции – точка, которая находится на уровне латерального угла глаза каудальнее глазничной связки и вентральнее области ее прикрепления к скуловому отростку лобной кости. Игла вводится под кожу вентрально под углом 45–60° по направлению к носовому зеркалу. Кончик иглы должен располагаться каудомедиально от связки, но не выходить за ее пределы. Половина объема анестетика вводится в этой точке, после чего игла извлекается и направляется вверх до уровня наружного угла орбиты в той же плоскости, где вводится вторая половина объема анестетика (рис. 6, 7)4.
Доза: 0,04 мл/кг анестетика. Общий объем анестетика распределяется на две анатомические точки4.
Блокада большого затылочного нерва
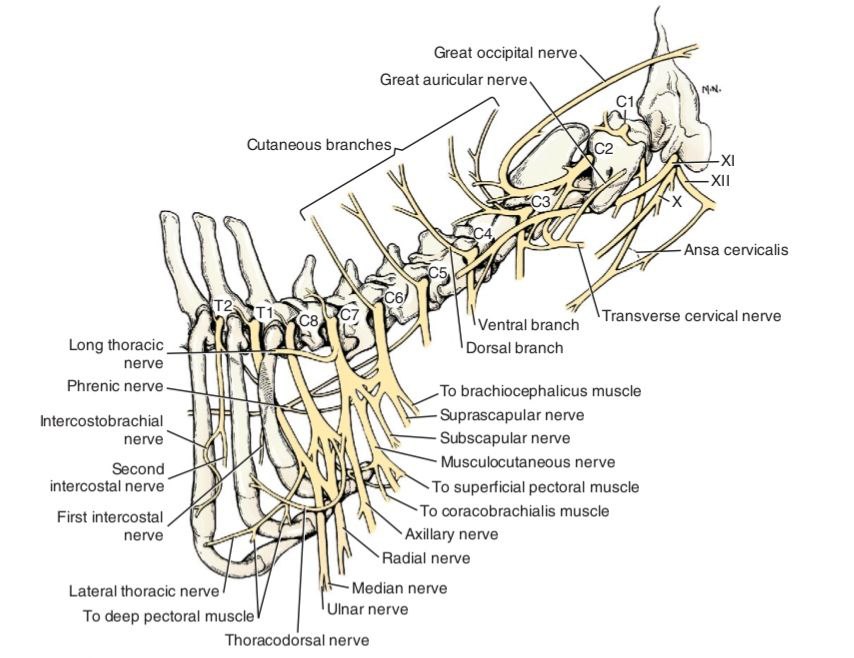
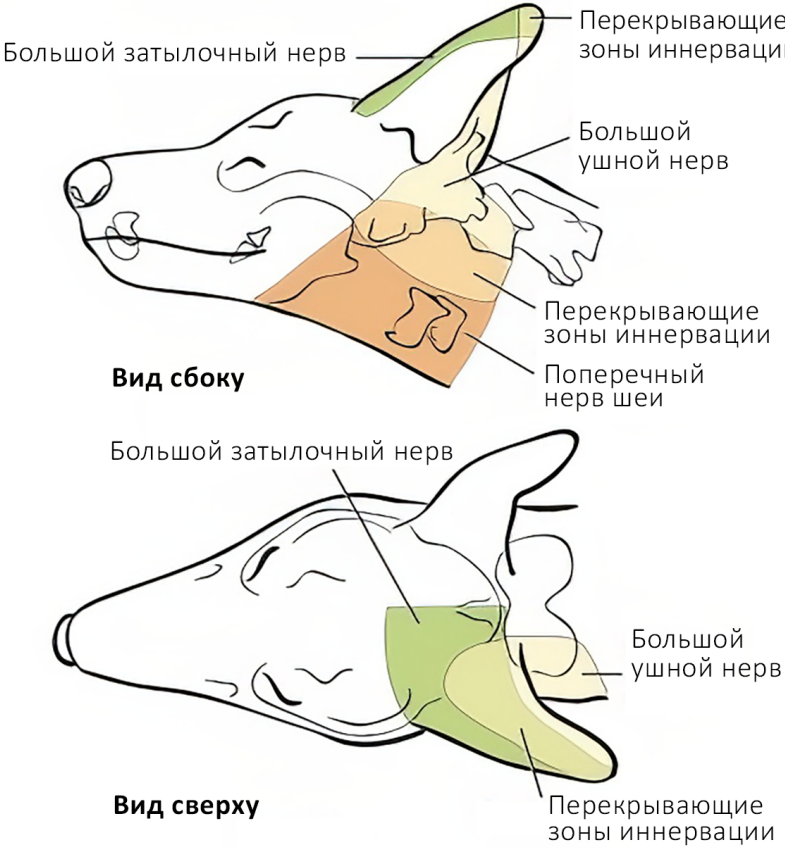
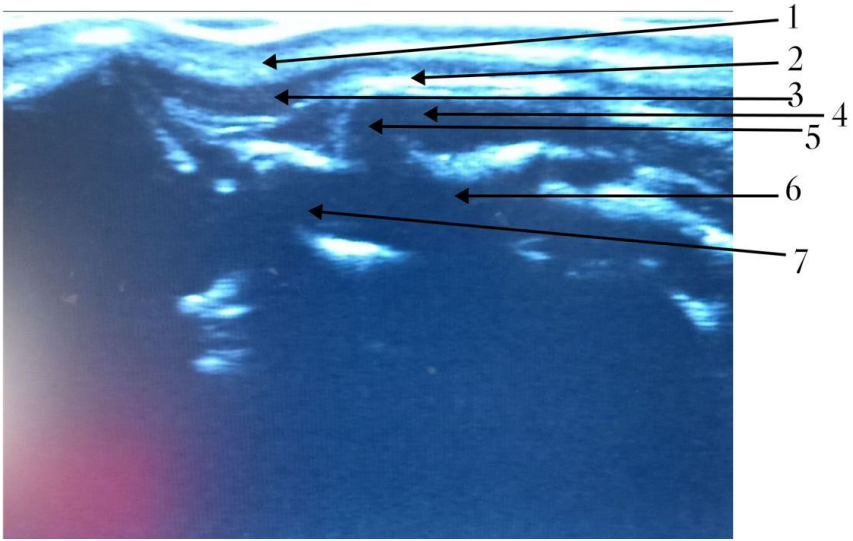
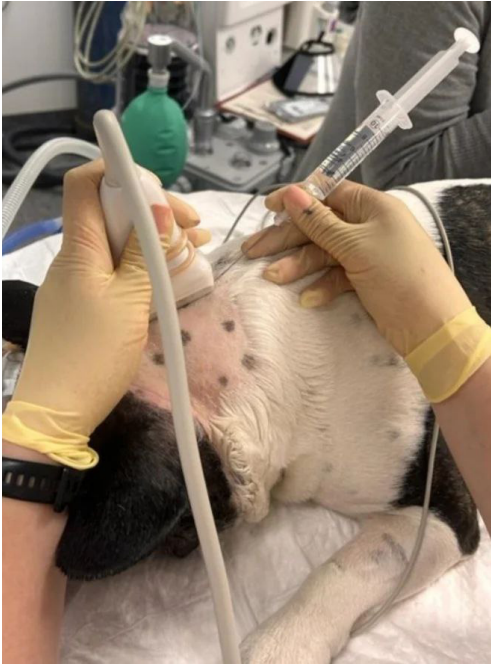
Большой затылочный нерв (n. occipitalis major) отходит от дорсальных корешков спинного мозга в области эпистрофея и обеспечивает сенсорную иннервацию области, расположенной каудально от черепа, начиная от атланта и заканчивая основанием затылочного гребня; далее он разветвляется, обеспечивая чувствительную иннервацию кожи головы в лобной области и ростральной части ушной раковины (рис. 8, 9)4,7. Блокада выполняется с использованием анатомических ориентиров или с применением ультразвуковой навигации для визуализации мышц и сосудов (рис. 11). Существует два способа проведения блокады: ростральный и каудальный. Для достижения максимальной эффективности эти способы рекомендуется комбинировать (рис. 10)4. Для выполнения блокады необходимо согнуть голову пациента вентрально к груди, что напоминает положение головы при вентрофлексии (рис. 13)4.Техника проведения:
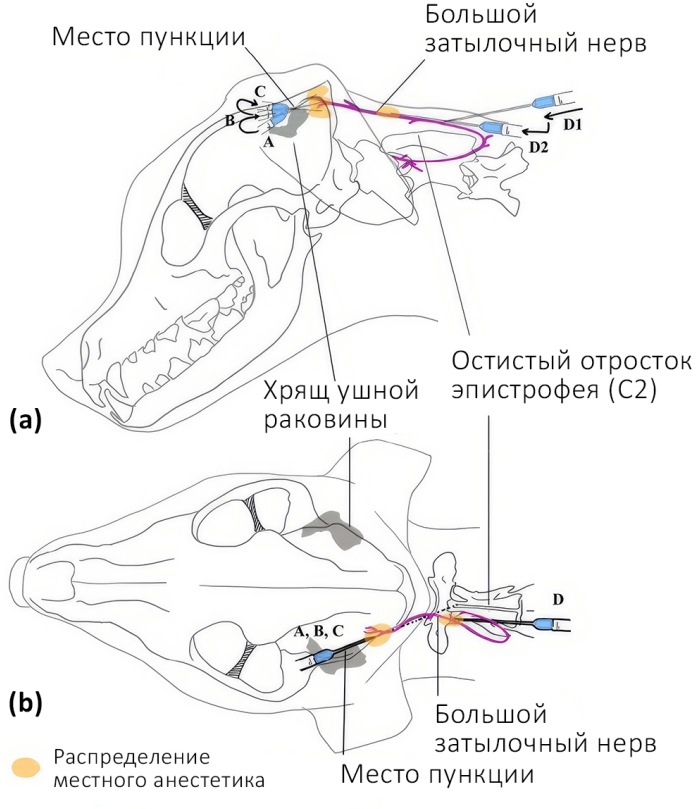
- Ростральный способ. Пальпаторно определяется место пункции – точка, которая располагается медиальнее от каудомедиального угла хряща ушной раковины. Игла вводится перпендикулярно под кожу, после чего продвигается вглубь тканей до надкостницы по направлению к затылочному гребню4 (рис. 14). Доза: 0,12 мл/кг анестетика. Половина объема вводится на максимальной глубине, половина – при извлечении иглы. Раствор вводится в течение 30–40 сек. без усилия для более равномерного распределения анестетика4.
- Каудальный способ. Пальпаторно определяется место пункции – точка, которая располагается дорсолатерально от каудального края остистого отростка эпистрофея между прямой дорсальной большой мышцей головы и двубрюшной мышцей шеи. Двубрюшную мышцу шеи можно найти при глубокой пальпации мышц латерально от средней линии шеи. Иглу вводят в данной точке перпендикулярно под кожу, далее на всю глубину между мышцами продвигают параллельно остистому отростку эпистрофея по направлению к его краниальному краю (рис. 11, 12, 13)1,4. Доза: 0,04 мл/кг анестетика. Половина объема вводится в самой глубокой точке, вторая половина – при извлечении иглы4.
Клинический случай № 1
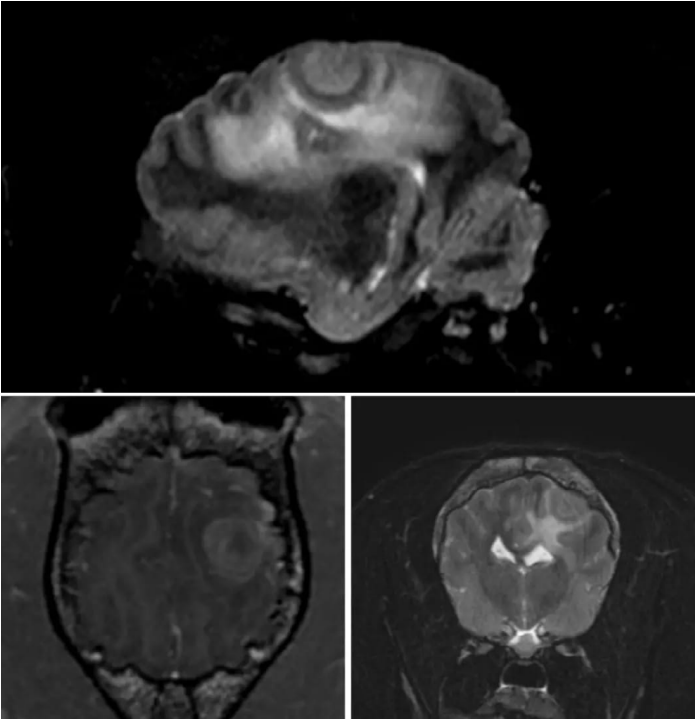
Пациент: собака породы французский бульдог, 6 лет. Новообразованиев лобно-теменной области. Проведена краниотомия с целью удаления новообразования ГМ. По результатам гистологического исследования был поставлен диагноз «низкодифференцированное злокачественное новообразование» (рис. 15; видео 1).
Схема анестезии: премедикация – медетомидин; индукция – пропофол + диазепам; поддержание – севофлуран.
Анальгезия: блокада лобного нерва + блокада большого затылочного нерва с использованием ропивакаина и дексаметазона в качестве адъюванта + аппликационная анестезия по месту разреза ТМО с использованием лидокаина.
В ходе анестезии у пациента наблюдалось кратковременное снижение частоты сердечных сокращений (ЧСС) на 20% от исходного уровня без влияния на артериальное давление (АД) после завершения доступа к ГМ, что обусловлено вегетативными реакциями нервной системы. Для поддержания анестезии использовался севофлуран в низких дозах (минимальная альвеолярная концентрация (МАК) – 0,2–0,3). Показатели интра- и послеоперационного мониторинга находились в пределах референсных значений. Для предотвращения дилатации сосудов ГМ проводилась искусственная вентиляция легких (ИВЛ), чтобы избежать гиперкапнии. Применение системных анальгетиков во время операции и в раннем послеоперационном периоде пациенту не потребовалось.
Пациент был выписан из ОРИТ спустя 24 ч. после проведения оперативного вмешательства (из них 12 часов провел в ОРИТ по желанию владельцев).
Клинический случай № 2
Пациент: собака породы французский бульдог, 7 лет. Новообразование в области грушевидной доли ГМ. Проведена краниотомия с целью удаления новообразования ГМ. По результатам гистологического исследования был поставлен диагноз «астроцитома» (рис. 16; видео 2)Схема анестезии: премедикация – дексмедетомидин; индукция – пропофол; поддержание – севофлуран.
Анальгезия: блокада скуловисочного нерва + блокада большого затылочного нерва с использованием ропивакаина и дексаметазона в качестве адъюванта.
Для поддержания анестезии у данного пациента также использовался севофлуран в низких дозах (минимальная альвеолярная концентрация – 0,2–0,4). Все параметры интраоперационного мониторинга находились в пределах референтных значений. Для предотвращения дилатации сосудов головного мозга проводилась ИВЛ, чтобы избежать гиперкапнии. Применение системных анальгетиков во время операции и в раннем послеоперационном периоде пациенту не потребовалось.
Пациент был выписан из ОРИТ спустя 12 ч. после проведения оперативного вмешательства.
Продолжение в следующем номере
Список литературы:
- IMAIOS vet-anatomy. The Anatomy for veterinary imaging. ссылка
- Куликов А. С., Тере В. А., Имаев А. А., Лубнин А. Ю. Регионарная анестезия скальпа – базовый анальгетический компонент анестезии при проведении супратенториальной краниотомии // Регионарная анестезия и лечение острой боли. Т 15, № 2, С. 119–126, 2021. DOI: ссылка
- Пенькова И. А., Новикова И. А. Анестезиологические аспекты краниотомии в сознании (литературный обзор) // Российский нейрохирургический журнал имени профессора А. Л. Поленова. Т. 8, № 3, 2016.
- Kushnir Y., Marwitz G. S., Shilo-Benjamini Y., Milgram J. Description of a regional anesthesia technique for the dorsal cranium in the dog: a cadaveric study // Veterinary Anaesthesia and Analgesia, 2018. DOI: 10.1016/j.vaa.2018.05.006
- Tanya Duke-Novakovski, Marieke de Vries, Chris Seymour. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia: third edition / BSAVA, 2016.
- Manual of small animal regional anesthesia: illustrated anatomy of nerve stimulation and ultrasound-guided nerve block / Pablo E. Otero, Diego A. Portela. – 2 ed. ampliada. – Ciudad Autonoma de Buenos Aires: Inter-Medica, 2018.
- Miller’s anatomy of the dog. ISBN: 978-143770812-7 Copyright © 2013, 1993, 1979, 1964 by Saunders, an imprint of Elsevier Inc.
- Закирова О. В. Адъюванты в регионарной анестезии // Журнал «Ветеринарный Петербург», № 4, 2023.
- Маркевич Д. П., Марочков А. В. Блокады периферических нервов в анестезиологическом обеспечении нейрохирургических вмешательств на голове // Регионарная анестезия и лечение острой боли, 11(4): 270–278, 2017.
- Marco AA Pereira, Karina D. Campos, Lucas A. Gonçalves, Rosana St. Dos Santos, et al. Cyclooxygenases 1 and 2 inhibition and analgesic efficacy of dipyrone at different doses or meloxicam in cats after ovariohysterectomy // Veterinary Anaesthesia and Analgesia, 2020. DOI: 10.1016/j.vaa.2020.10.004.

 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург