Введение
Врожденные портосистемные шунты (ПСШ) характеризуются наличием аномального сосуда (сосудов) между воротной системой печени и каудальной полой веной, минуя типичный внутрипеченочный кровоток. Портальная кровь, которая обычно течет через печень, вместо этого поступает непосредственно в системный кровоток. Недостаток кровотока через печень приводит к недоразвитию печени и зачастую к появлению клинических симптомов печеночной недостаточности из-за отсутствия печеночной функции. Патологический сосуд может располагаться внутри печени или вне печеночной ткани.При наличии внепеченочного шунта во время операции шунтирующий сосуд идентифицируется, подтверждается, и, как правило, на него накладывается амероидный констриктор (или целлофан), обеспечивающий постепенное лигирование.
Пациенты с портальными венозными шунтами и дисфункцией печени, как правило, представляют собой наиболее сложные случаи в практике ветеринарного врача-анестезиолога1. Чаще всего это молодые щенки карликовых пород, имеющие низкий индекс массы тела, кахексию, недоразвитые в соответствии со своим возрастом, плохо поддерживающие во время наркоза уровень глюкозы крови, температуру тела и артериальное давление. Результаты лабораторных исследований у таких пациентов показывают умеренную анемию, гипоальбуминемию. Если принять во внимание продолжительную операцию на открытой брюшной полости и возможное кровотечение, становится понятно, что подход к таким пациентам должен быть весьма осторожным.
Физиологические отклонения, обычно связанные с печеночной дисфункцией и печеночной недостаточностью1: печеночная энцефалопатия, гипокалиемия, гипогликемия, гипоальбуминемия, асцит, коагулопатия, гипотензия, нарушение биотрансформации лекарственных средств.
Примечание: эти отклонения могут присутствовать или отсутствовать у пациента с печеночной дисфункцией1.
Животные весом до 3 кг склонны к гипотермии во время анестезии, что является фактором, способствующим длительному восстановлению после анестезии. Из-за нарушений метаболизма глюкозы в печени пациенты с ПСШ не способны поддерживать нормогликемию, поэтому им не рекомендована длительная голодная диета перед операцией. Мы рекомендуем кормление небольшим объемом промышленного корма в виде паштета за 4 часа до операции.
В процессе метаболизма большой процент лекарственных препаратов связывается с альбумином плазмы. У пациентов с портосистемным шунтированием (вследствие гипоальбуминемии) часть препаратов длительно циркулирует в кровяном русле в несвязанном виде, что повышает риск кумулятивного эффекта и замедляет реверсию пациента из анестезии.
Также во время наркоза часто встречается гипотензия, обусловленная гиповолемией, гипоальбуминемией и гипотермией. Альбумин обеспечивает онкотическое давление плазмы и поддержание внутрисосудистого объема. При гипоальбуминемии развитие гипотензии является типичным и зачастую усугубляется при введении общих анестетиков. Хирургические манипуляции в брюшной полости у пациентов весом до 3 кг могут усугубить гипотензию, препятствуя венозному возврату. За редким исключением большинство анестетиков подвергаются биотрансформации в печени до активных или неактивных соединений. Метаболизм анестетиков и анальгетиков также может быть нарушен у пациентов с заболеванием печени, что приводит к длительному действию препаратов.
Замедленное пробуждение пациентов после анестезии может быть результатом остаточного или длительного действия лекарств, гипотермии и гипогликемии.
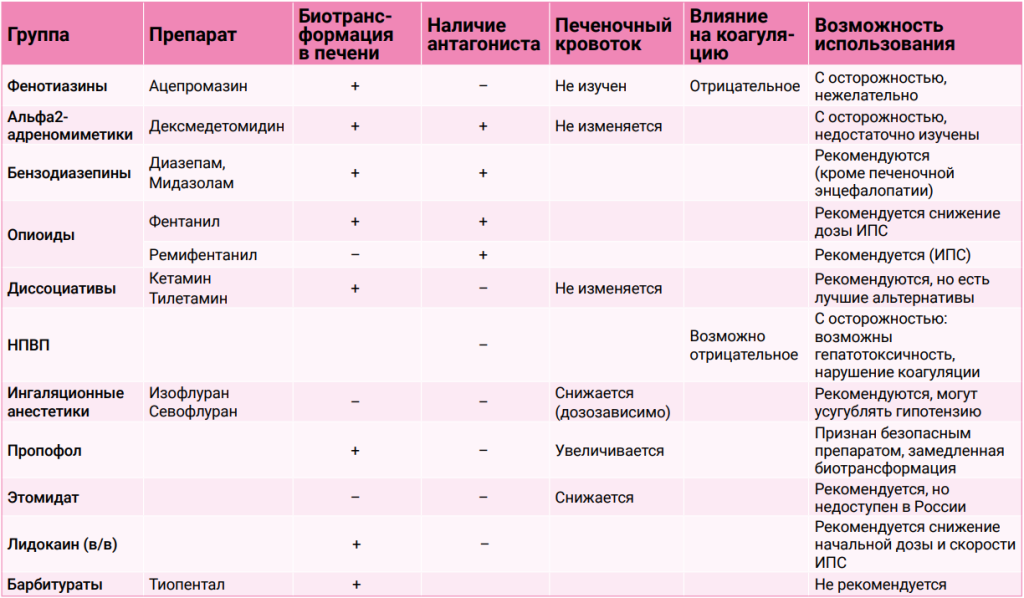
Рекомендации наших иностранных коллег1,2 по ведению пациентов с заболеваниями печени сводятся к ограниченному использованию препаратов, подвергающихся биотрансформации в печени, усугубляющих гипотензию, не имеющих антагонистов, нарушающих коагуляцию и снижающих кровоток в печени. Рекомендуется применять опиоиды самого короткого действия, начальную дозу опиоида необязательно снижать, если имеется заболевание печени. Последующие дозы могут быть определены путем титрования до достижения эффекта, однако (вероятно)может потребоваться увеличение интервала между введениями. При использовании инфузии с постоянной скоростью пациентам с портальными венозными шунтами и дисфункцией печени требуется более низкая доза препарата в отличие от пациентов без ПСШ. Этомидат и пропофол безопасны для этих животных, но выведение последнего препарата замедляется при печеночной дисфункции, а первый недоступен в России. Ингаляционные анестетики могут дозозависимо усугублять гипотензию и снижать печеночный кровоток. Диссоциативы применяют с осторожностью, поскольку их метаболизм зависит от работы гепатоцитов и стандартные дозировки могут оказаться избыточными. НПВП могут вызывать гепатотоксичность и нарушать агрегацию тромбоцитов.
В целом безопасно использовать комбинацию бензодиазепинов (при отсутствии печеночной энцефалопатии) и опиоидов короткого действия2.
Задачами анестезиолога являются: предотвращение дальнейшего повреждения печени, обеспечение максимальной доставки кислорода в печень, использование анестетиков короткого действия («не полагаясь на печень») для метаболизма и/или обратимых анестетиков. Абдоминальная хирургия может привести к снижению печеночного кровотока из-за прямого сжатия печеночной сосудистой сети хирургическими манипуляциями, а также из-за активации симпатической нервной системы, связанной с хирургическим стрессом и болью. Сосудистая сеть печени обильно иннервируется α1-адренорецепторами, высвобождение катехоламинов при активации симпатической нервной системы вызывает вазоконстрикцию, тем самым уменьшая печеночный кровоток.
По личным наблюдениям автора, во время операций по закрытию портосистемных шунтов использование таких опиоидных препаратов, как фентанил, значительно увеличивает время пробуждения пациентов по сравнению с пациентами без ПСШ. Применение фентанила в монорежиме чревато либо использованием максимальных доз, либо недостаточным контролем над ноцицепцией. По этой причине в своей практике автор статьи применяла анестезиологический протокол, состоящий из индукции пропофола, болюса ФЛК (фентанил – лидокаин – кетамин) с переходом на ИПС (инфузию с постоянной скоростью) ФЛК в сниженных дозировках. Полное пробуждение пациента после операции с таким анестезиологическим протоколом происходит в ОРИТ, эти животные просыпаются длительно, иногда пробуждение сопровождается гипогликемией, абдоминальной болью.
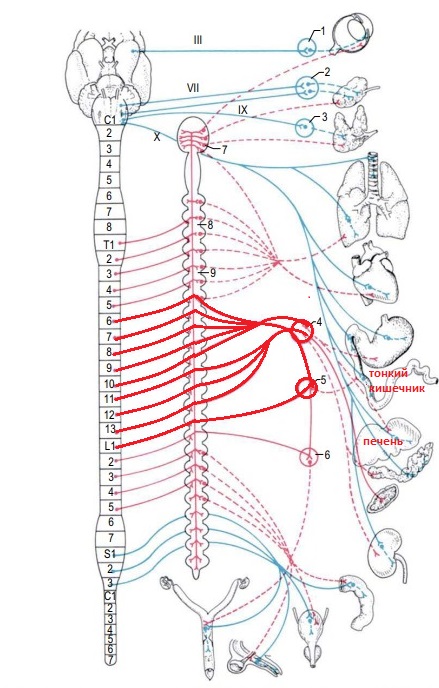
Использование эпидуральной анестезии широко распространено у мелких домашних животных. Традиционным местом введения местного анестетика при проведении эпидуральной анестезии является область L7-S1, что обеспечивает краниальное распространение препарата ориентировочно до уровня Th10 (при использовании дозировок 0,2–0,4 мл/кг). Печень и тонкий отдел кишечника иннервируются от сегментов спинного мозга на уровне Тh6-L1 (рис. 1).
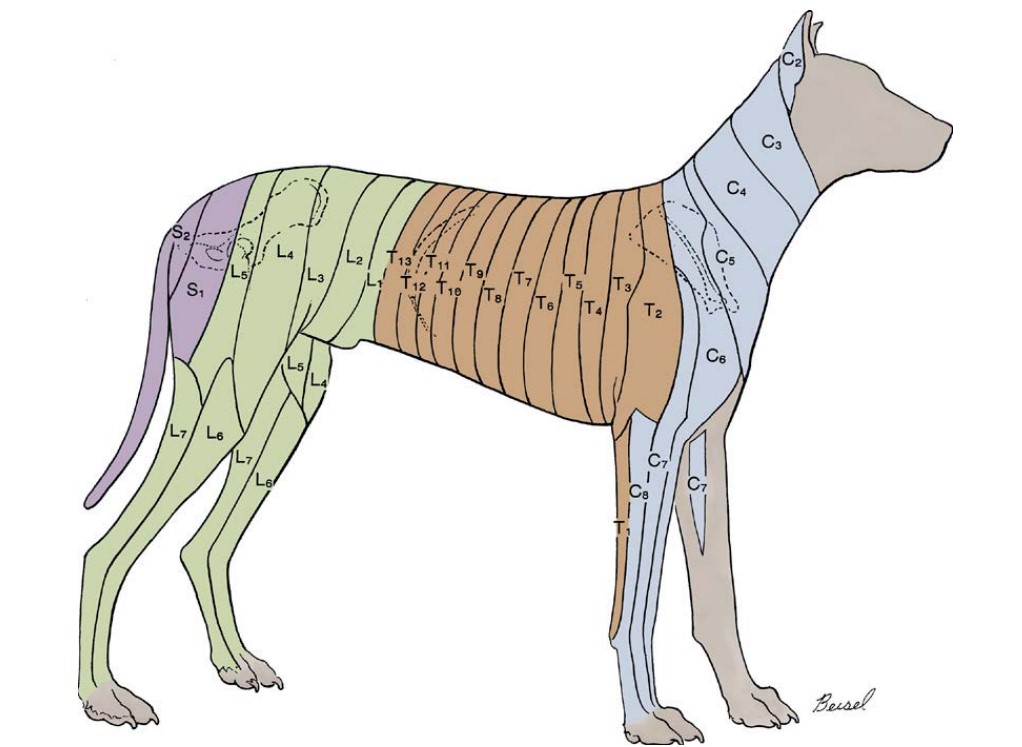
Дерматомы (участки кожи, сенсорная иннервация которых осуществляется одним спинномозговым нервом), находящиеся в зоне операционного доступа при ПСШ, иннервируются на уровне T9-L3 (рис. 2).
Торакальная эпидуральная анестезия (ТЭА) при операциях на грудной и брюшной полостях используется в гуманной медицине и имеет некоторые преимущества по сравнению с протоколами обезболивания, которые не включают регионарные методы12. Уменьшение выраженности гипотензии, снижение частоты сердечных аритмий и ранняя экстубация – все это признанные преимущества регионарной анестезии по сравнению со сбалансированной анестезией с использованием ингаляционных анестетиков и системных опиоидов. Чтобы свести к минимуму побочные эффекты, связанные с обширной нейроаксиальной блокадой, кончик эпидурального катетера рекомендуют располагать как можно ближе к подлежащему блокировке участку спинного мозга.
В нашей клинике за последний год ТЭА получила широкое распространение (статья Нестеровой С. В. «Эпидуральная анестезия при операциях на позвоночнике у мелких домашних животных». «Ветеринарный Петербург» № 2. 2022, spbvet.info). Однако при хирургическом лечении портосистемных шунтов мы начали ее применять позднее.
Применение ТЭА при серьезных хирургических вмешательствах на грудной и брюшной полостях у собак описано в исследовании6, посвященном сравнительной характеристике периоперационных обезболивающих эффектов применения TЭA (ропивакаин + морфин) и интратекального введения морфина. В ходе исследования собаки были случайным образом распределены в две группы (по 18 в каждой): первая группа – ТЭА смесью 0,5%-ного раствора ропивакаина (0,2 мг/кг) и морфина (0,1 мг/кг) на уровне Th12-Th13; вторая группа – спинальная анестезия только морфином (30 мкг/кг) на уровне L6-L7. Эффективность анальгезии в первой группе была значительно выше, чем во второй. Лишь одной из 18 собак в первой группе потребовался внутривенный болюс фентанила во время операции, и ни одна из них не получала интраоперационный фентанил в режиме ИПС, тогда как 16 из 18 собак во второй группе нуждались в 26 болюсах фентанила (в общей сложности), а 15 из 18 получали фентанил в режиме ИПС во время операции. Послеоперационная анальгезия потребовалась двум из 18 собак из первой группы и 10 из 18 во второй группе.
На основании данного исследования автор статьи сделала для себя вывод о преимуществе использования местных анестетиков в составе ТЭА.
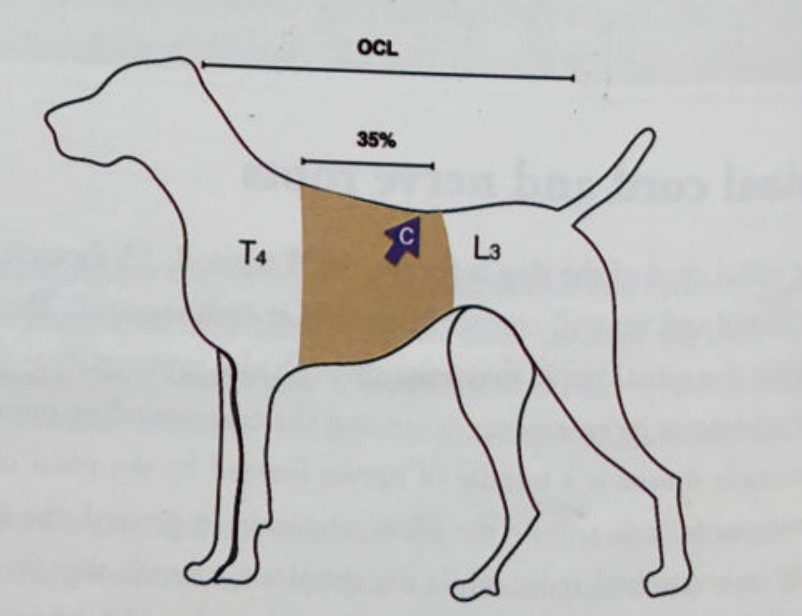
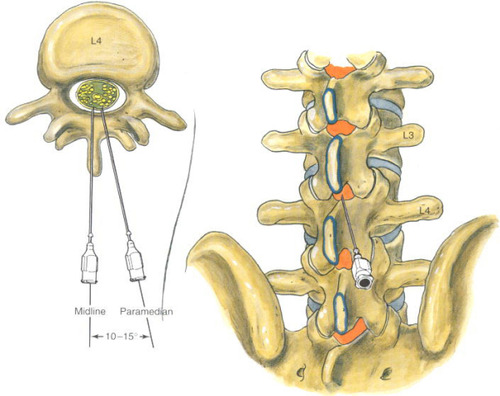
Распространение местного анестетика в эпидуральном пространстве в основном зависит от места пункции и объема введенного препарата. Один из вариантов расчета объема анестетика при TЭA представлен в книге «Руководство по регионарной анестезии мелких животных»4: 0,05 мл*см OCL, где OCL – это длина от затылка до первого хвостового позвонка в сантиметрах (рис. 3).
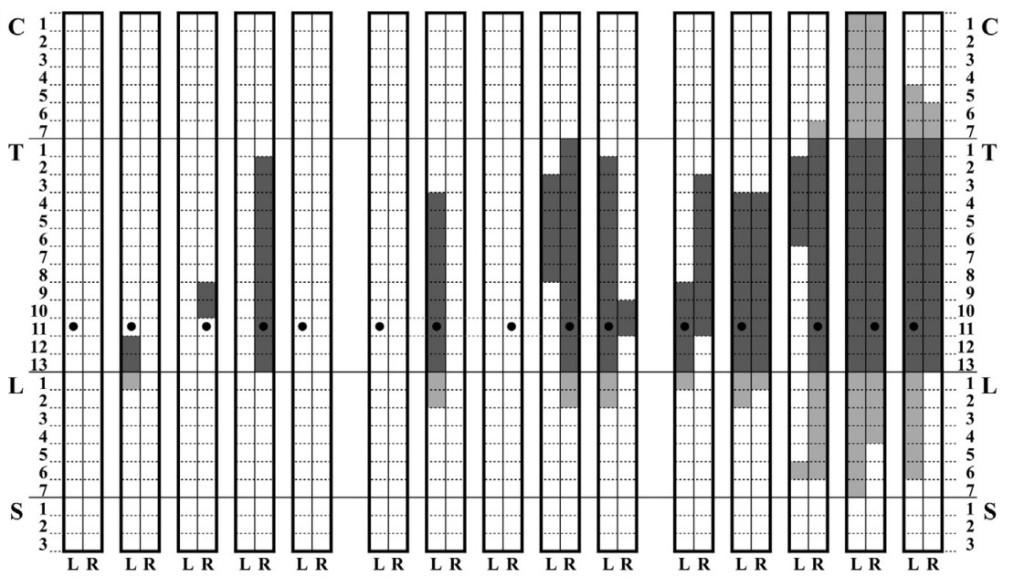
Показательными являются исследования8,9, оценивающие эффект распределения местного анестетика (2%-ного раствора лидокаина) и контрастного вещества (йогексола) при введении различных объемов (0,05; 0,10; 0,15 и 0,20 мл/кг) в эпидуральное пространство на разных уровнях (в том числе на уровне Th11). Сенсорная блокада (СБ) дерматомов оценивалась путем защемления кожи кровоостанавливающим зажимом, а распространение йогексола для визуализации эпидурального распределения – посредством КТ. Начало СБ развивалось в течение 5 минут после эпидуральной инъекции лидокаина, а степень СБ достигала пика в течение 20 минут. Неоднородность эпидуральной блокады чаще всего наблюдалась при использовании малых объемов, и только дозировка 0,2 мл/кг обеспечивала двусторонний сенсорный блок (рис. 4).
По результатам приведенных исследований был сделан вывод о том, что при введении малого объема местного анестетика возрастают риски его неравномерного распределения. На основании этих выводов автором статьи было принято решение об использовании в своей практике дозировки 0,2 мл/кг.
В одном из опубликованных исследований7 было сделано заключение о том, что под влиянием ТЭА при операциях у собак печеночный кровоток увеличивается, несмотря на снижение среднего артериального давления, вероятно, из-за симпатической блокады и расширения сосудов печени. Однако стоит отметить, что существуют противоречивые данные по этому вопросу, например, по результатам исследования, проведенного в гуманной медицине, были получены противоположные результаты13.
Анализ личного опыта автора статьи по ведению пациентов с внепеченочными ПСШ
Основываясь на вышеизложенных данных, автор статьи постепенно меняла подход к ведению пациентов с внепеченочными портосистемными шунтами. В период отсутствия в клинике фентанила было принято решение использовать внутривенное введение буторфанола (в составе БЛК: буторфанол – лидокаин – кетамин), но анальгетическая активность у него гораздо ниже фентанила, период полувыведения больше, зависимость от печеночной трансформации выше. Результат был неудовлетворительный: продленное восстановление сознания у пациентов после операции и выраженная болезненность брюшной полости в первые сутки после операции.При использовании ЭА с пункцией в области L7-S1 во время операции возникла необходимость в болюсном введении фентанила, а в послеоперационном периоде – продленной анальгезии.
Из-за неудовлетворительного контроля ноцицепции в интраоперационном периоде и контроля боли в послеоперационном периоде было принято решение об использовании ТЭА.
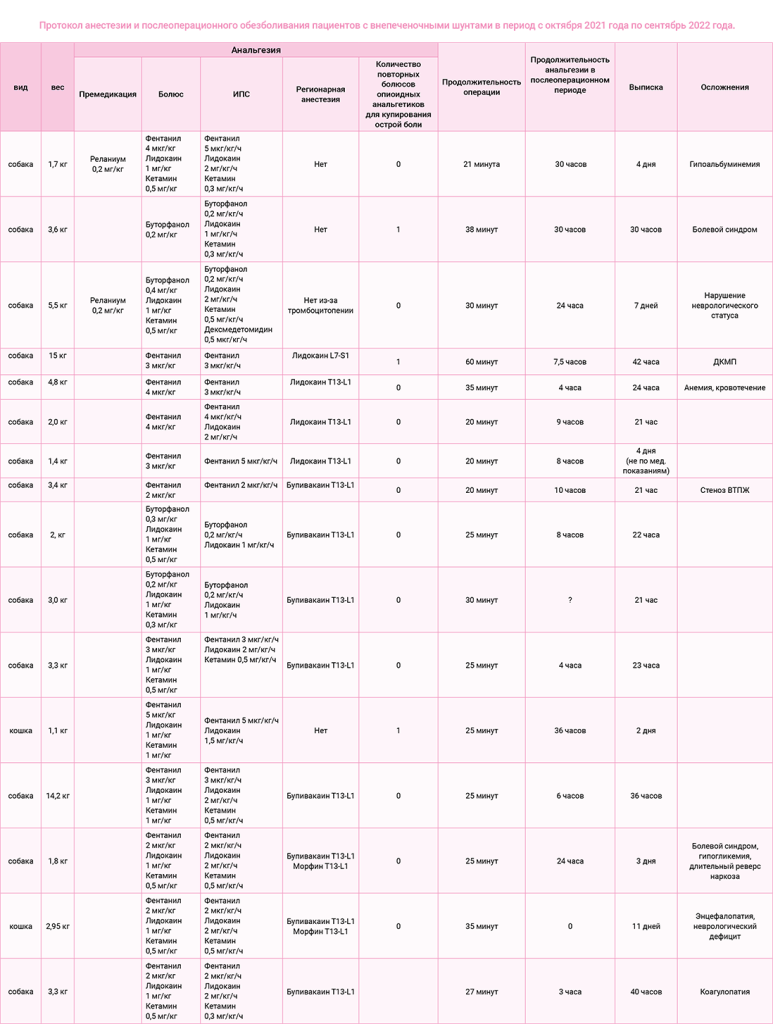
В период с октября 2021 года по сентябрь 2022 года автором успешно были проведены 11 ТЭА у пациентов с внепеченочными шунтами. В течение этого периода только у двух пациентов с внепеченочными шунтами не использовалась ТЭА. У одного из них была выраженная тромбоцитопения, и ЭА не проводилась, поскольку тромбоцитопения наряду с коагулопатией являются абсолютными противопоказаниями для ЭА.
Еще один пациент, 3-месячный котенок, в этот период не получил ТЭА из-за своих миниатюрных размеров.
Первым местным анестетиком, который автор использовал у пациентов с ПСШ для проведения ТЭА, был 1%-ный раствор лидокаина. Такой выбор был сделан из-за короткого времени действия препарата и непродолжительных возможных побочных реакций. Интраоперационный период у пациентов, получивших ТЭА лидокаином, прошел без особенностей и не требовал использования болюсов фентанила. Однако в послеоперационном периоде применялась ИПС ФЛК из-за выраженной болезненности брюшной полости. В дальнейшем лидокаин был заменен 0,5%-ным раствором бупивакаина из-за его более продолжительного действия. Периоперационный период проходил без особенностей, пациентам ни разу не потребовалось введение болюсов фентанила интраоперационно. В раннем послеоперационном периоде реже возникала необходимость в дополнительном использовании анальгетиков.
Следующим этапом при использовании ТЭА к 0,5%-ному раствору бупивакаина был добавлен морфин, однако значимого отличия от использования только бупивакаина в послеоперационной анальгезии автор статьи не отметила.
Придерживаясь мультимодального подхода к анальгезии пациентов, автор всегда использовала сочетание ТЭА с ИПС системных препаратов (чаще всего ФЛК), но их дозы были значительно снижены.
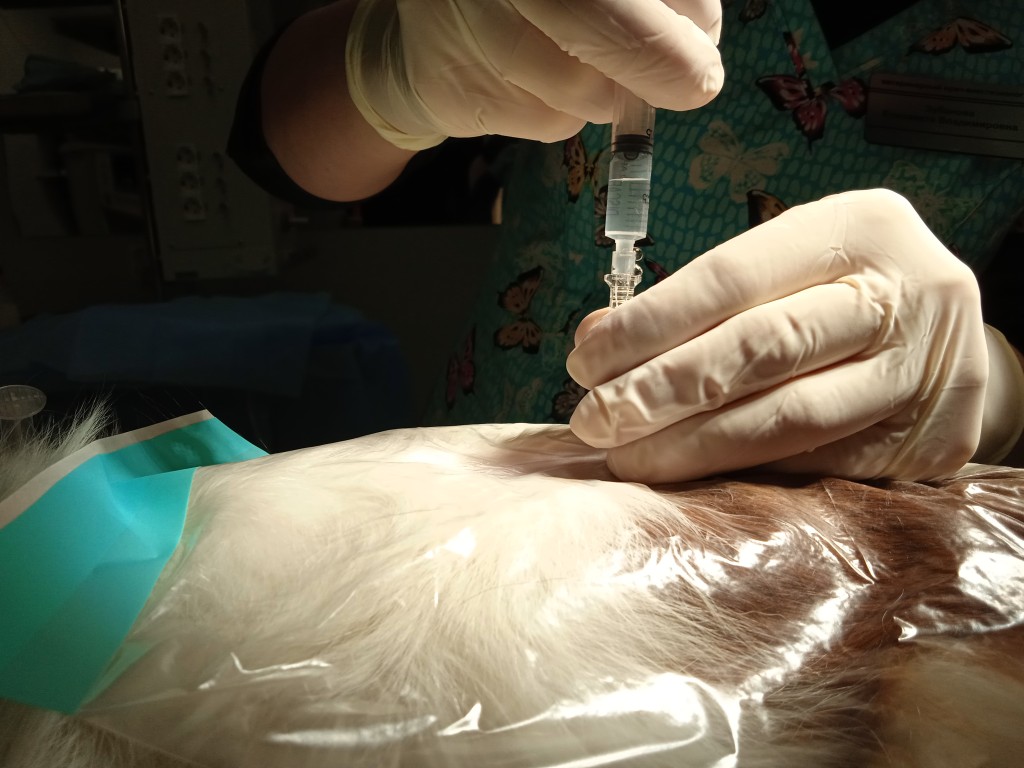
Технически выполнение ТЭА сложнее, чем выполнение ЭА на уровне L7-S1. В своей практике автор статьи использует однократную пункцию эпидурального пространства с помощью спинальной иглы в промежутке Th13-L1 или L1-L2, пациент перед выполнением торакальной эпидуральной пункции находится в стернальном положении (рис. 5).
Во время пункции предпочтительнее использовать латеральный доступ (рис. 6, 7), поскольку из-за более острого угла расположения иглы уменьшается риск перфорации твердой мозговой оболочки.
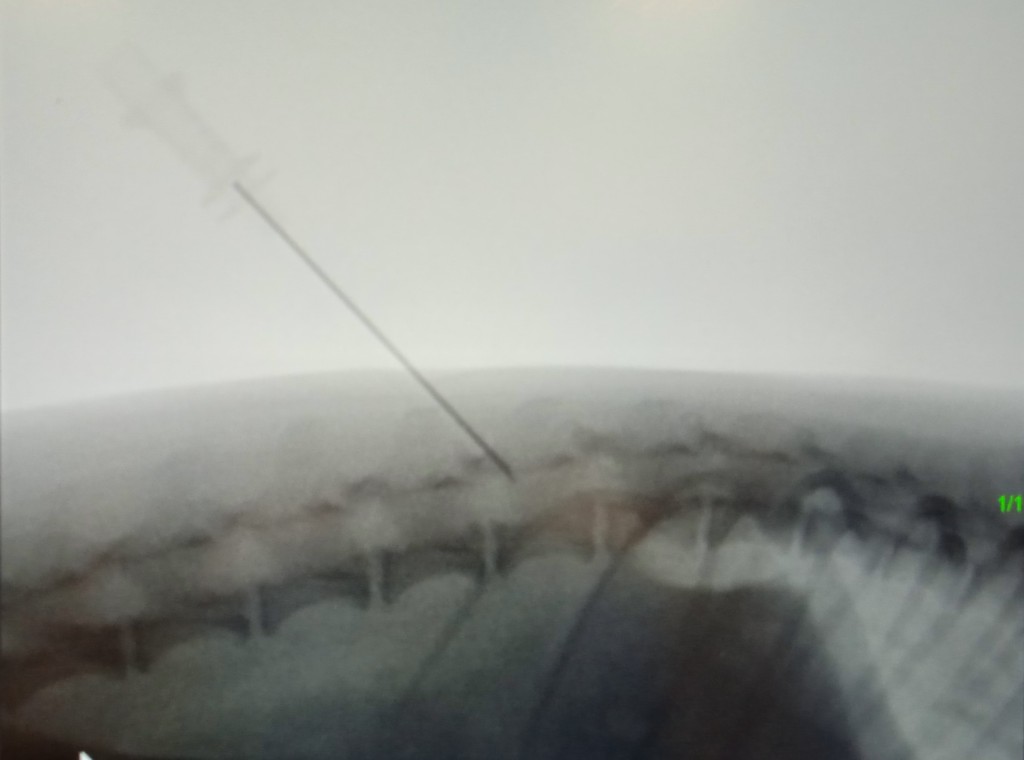
При проведении однократной торакальной эпидуральной пункции используются спинальные иглы с мандреном. после удаления мандрена необходимо удостовериться в отсутствии ликвора и крови во втулке спинальной иглы. Часто (но не всегда) из-за отрицательного давления в эпидуральном пространстве при заполнении втулки спинальной иглы раствором можно наблюдать засасывание раствора. При локализации кончика иглы в эпидуральном пространстве пропадает сопротивление к инъекции воздуха или жидкости. Для контроля сопротивления в шприц с местным анестетиком набирается небольшой объем воздуха, который при пункции в эпидуральное пространство не должен сжиматься более чем на 50% (рис. 8).
Выводы
Несмотря на то что при современном уровне анестезии доступны различные схемы и препараты, обезболивание пациентов с заболеваниями печени все еще остается очень сложной задачей. В случае проведения общей анестезии использование ингаляционных средств в сочетании с небольшими дозами фентанила может рассматриваться как разумный выбор.Альтернатива системных анальгетиков – использование методов регионарной анестезии, в частности ТЭА.
Воздействие ТЭА на пациентов с внепеченочными портосистемными шунтами до конца не исследовано, но автор статьи считает ее применение у подобных пациентов оправданным. В этих случаях используются более низкие дозировки системных препаратов, местно вводимые препараты оказывают меньшее системное действие. Качество анальгезии интраоперационно и постоперационно достоверно выше при использовании методов регионарной анестезии.
Оправдано использование местных анестетиков длительного действия даже при непродолжительной операции, так как в послеоперационном периоде уровень боли может быть значимым.
Латеральный доступ, возможно, менее травматичен и меньше ассоциируется с непреднамеренной спинальной пункцией.
При необходимости продленной анальгезии в послеоперационном периоде можно использовать эпидуральный катетер.
Абсолютными противопоказаниями к использованию ТЭА являются коагулопатия, гиповолемия, инфицирование места инъекции.
Во время использования ТЭА при оперативном лечении внепеченочных ПСШ автору ни разу не пришлось использовать болюсы опиоидов интраоперационно, что часто наблюдалось при анестезиологическом протоколе без ТЭА. Время пробуждения всех пациентов с использованием ТЭА было меньше, чем у пациентов без ТЭА. Послеоперационный период требовал меньшего использования дополнительных анальгетиков.
Скачать протокол.
Список литературы:
- Lindsey B. C. Snyder and Rebecca A. Johnson. Canine and feline anesthesia and coexisting disease, 2015.
- Karol A. Mathews, Melissa Sinclair, Andrea M. Steele and Tamara Grubb, Analgesia and anesthesia for the ill or injured dog and cat, 2018.
- Poul Hyttel, Denmark Fred Sinowatz, Morten Vejlsted, Essentials of Domestic Animals Embryology, 2010.
- Pablo E. Otero, Diego A. Portela, Manual of Small Animal Regional Anesthesia: Illustrated Anatomy for Nerve Stimulation and Ultrasound-Guided Nerve Blocks Second edition, 2019.
- Lorenz M. D., Coates J. R., Kent M. Neurologic History, Neuroanatomy, and Neurologic Examination. Handbook of Veterinary Neurology, 2011.
- Lardone E., Sarotti D., Giacobino D., Ferraris E. and Franci P. Thoracic epidural anaesthesia vs intrathecal morphine in dogs undergoing major thoracic and abdominal surgery: clinical study, BMC Veterinary Research, 2022.
- Toshie Iseri, Masaya Nakamori, Yuka Fujimoto. Effects of thoracolumbar epidural anesthesia with lidocaine on the systemic hemodynamics and hepatic blood flow in propofol anesthetized dogs, 2021.
- Son W., Jang M., Jo S., Yoon J., Lee I. The volume effect of lidocaine on thoracic epidural anesthesia in conscious Beagle dogs. Veterinary Anaesthesia and Analgesia, 42(4), 414–424, 2015.
- Won-Gyun S., Min J., Sang-Min J., Hyunseok K., Chi Won S., Inhyung L., Cranial versus caudal thoracic epidural anesthesia using three volumes of lidocaine in conscious Beagle dogs. Veterinary Anaesthesia and Analgesia, 2018.
- Poupak Rahimzadeh, Saeid Safari, Seyed Hamid Reza Faiz, Seyed Moayed Alavian. Anesthesia for Patients with Liver Disease. Hepat Mon, Jul 2014; 14(7): e19881. Published online 2014 Jul 1. doi: 10.5812/hepatmon.19881
- Hermanns H., Bos E. M. E., van Zuylen, M. L. et al. The Options for Neuraxial Drug Administration. CNS Drugs, 36: 877–896, 2022. Ссылка.
- Trepenaitis D., Pundzius J., Macas A. The influence of thoracic epidural anesthesia on liver hemodynamics in patients under general anesthesia. Medicina (Kaunas), 46(7): 46571, 2010. PMID: 20966619.
- Браун Дэвид Л. Атлас регионарной анестезии. Редактор: Гостищев Виктор Кузьмич, Издательство: ГЭОТАР-Медиа, 2009 г.

 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург