Вегетативная (автономная) нервная система состоит из двух основных отделов – симпатического и парасимпатического. Она выполняет множество функций: регулирует артериальное давление, двигательную активность желудочно-кишечного тракта, поддерживает постоянство внутренней среды организма, обеспечивает приспособительные реакции на изменяющуюся окружающую среду.
Симпатическая нервная система активируется во время стрессовых ситуаций для усиления функций организма, которые помогут ему выжить. Она отвечает за увеличение частоты сердечных сокращений, дыхания и притока крови к мышцам, снижает функцию желудочно-кишечного тракта и вызывает расширение зрачков. Симпатомиметики (лат. mimetes – подражатель) – препараты, которые воздействуют на организм подобно влиянию симпатической нервной системы. В этой статье мы рассмотрим их классификацию, фармакологию и особенности применения в анестезиологической практике.
Классификация симпатомиметиков
Симпатомиметики можно сгруппировать по способу действия. Препараты, которые напрямую взаимодействуют с адренорецепторами и активируют их, называются прямыми агонистами (например, адреналин, норадреналин). Препараты, которые способны усиливать действие эндогенных катехоламинов, являются непрямыми агонистами.Их эффект достигается за счет трех механизмов:
- Стимуляция высвобождения катехоламинов (адреналин, норадреналин, допамин) путем их вытеснения из нервных окончаний (например, так действует тирамин*).
- Ингибирование обратного захвата катехоламинов (так действуют кокаин и трициклические антидепрессанты, например амитриптилин).
- Предотвращение ферментативного метаболизма норадреналина (например, ингибиторы моноаминоксидазы)9.
Также симпатомиметики делятся по типу рецепторов, с которыми они взаимодействуют. Некоторые из них действуют только на альфа- или бета-рецепторы, такие препараты называются селективными. Другие симпатомиметики действуют одновременно на оба типа и называются неселективными (табл. 1).
Для лучшего понимания особенностей фармакологического действия разных групп симпатомиметиков рассмотрим подробнее сами рецепторы.
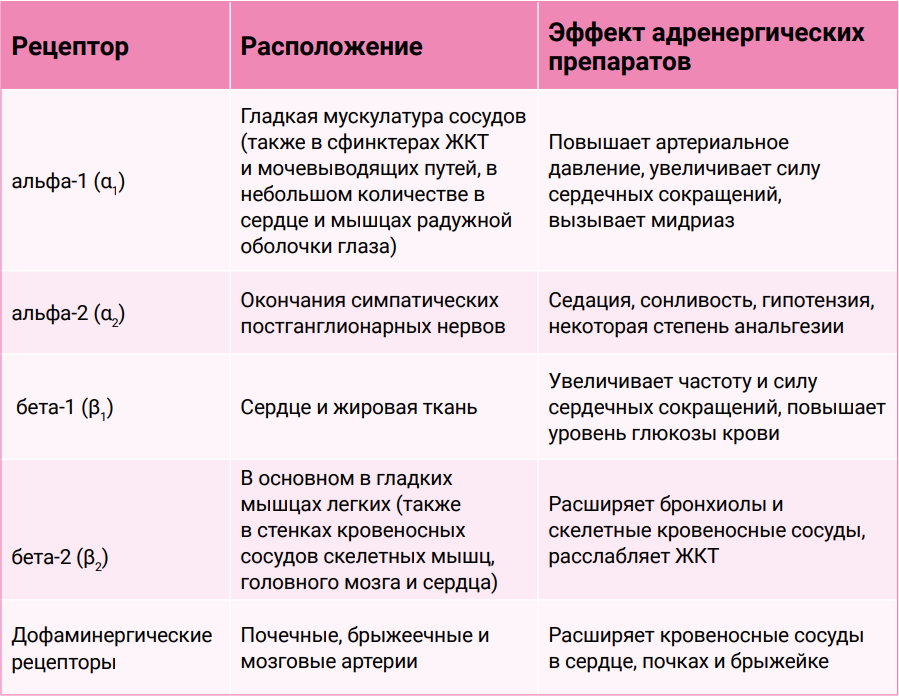
Классификация адренорецепторов
Адренорецепторы – это белки, которые находятся либо пресинаптически на мембране нейрона, либо постсинаптически на эффекторном органе и связываются с нейромедиаторами адреналина и норадреналина. Дофаминергические рецепторы связаны с адренорецепторами, поскольку дофамин является предшественником норадреналина. Существует несколько типов симпатических рецепторов, классифицируемых как альфа-1 (α1), альфа-2 (α2), бета-1 (β1) и бета-2 (β2) (табл. 2). От того, на какие рецепторы влияет препарат, зависит его эффект6.α1-адренорецепторы располагаются в гладких мышцах бронхов, радужной оболочки глаз, кишечника, органов мочеполовой системы и кровеносных сосудов. Активация этих рецепторов увеличивает концентрацию ионов кальция внутри клеток, что приводит к сокращению мышц. Клинически это проявляется как сужение кровеносных сосудов, мидриаз, сужение бронхов, сокращение матки, сфинктеров желудочно-кишечного и мочеполового трактов.
Хотя стимуляция α1-адренорецепторов вызывает множество эффектов, самый значительный из них – это сужение кровеносных сосудов, повышающее общее периферическое сопротивление сосудов (ОПСС), что, в свою очередь, приводит к росту артериального давления.
α2-адренорецепторы располагаются в основном пресинаптически на нервных окончаниях, постсинаптические α2-адренорецепторы находятся в гладкомышечных клетках сосудов. При активации снижается поступление Са2+ в нервные окончания, вследствие этого происходит ингибирование выделения норадреналина в синаптическую щель и подавление симпатических импульсов. Клинически эффект проявляется в периферической вазоконстрикции и выраженной седации, снижении симпатического влияния, ОПСС, артериального давления.
β1-адренорецепторы расположены постсинаптически и в подавляющем большинстве сосредоточены в сердце. Их стимуляция приводит к активации аденилатциклазы, что обеспечивает синтез цАМФ (циклический аденозинмонофосфат) из АТФ (аденозинтрифосфат) и инициирует каскад фосфорилирования киназы. Конечным эффектом агонистов β1-адренорецепторов является увеличение силы и частоты сердечных сокращений, облегчение проводимости.
β2-адренорецепторы – это главным образом постсинаптические адренорецепторы, расположенные в гладкомышечных и железистых клетках. Их стимуляция так же, как и β1-адренорецепторов, приводит к активации аденилатциклазы. Так как их локализация отличается, агонисты β2 вызывают совсем другие эффекты – бронходилатацию, вазодилатацию, расслабление матки (токолитическое действие), мочевого пузыря и кишечника. Происходит стимуляция гликогенолиза и глюконеогенеза, увеличивается секреция инсулина, активируется натрий-калиевый насос, который перемещает ионы калия внутрь клетки, что может способствовать возникновению гипокалиемии и аритмий.
Дофаминергические рецепторы расположены в почечных, брыжеечных и мозговых артериях, также обнаруживаются на пресинаптических адренергических нейронах, где их активация препятствует высвобождению норадреналина. Стимуляция дофаминергических рецепторов вызывает расширение кровеносных сосудов в сердце, почках и брыжейке.
Обзор препаратов
Мы рассмотрим пять основных симпатомиметиков, которые применяются в анестезиологии и интенсивной терапии. Помимо индивидуальных особенностей каждого препарата, все они имеют много общего.Основные принципы использования симпатомиметиков:
- выбор препарата осуществляется на основании причины развития патологического состояния пациента (патогенеза), а также исходя из того, на какие адренорецепторы требуется воздействовать для лечения этого состояния;
- в большинстве случаев применение препарата эффективно только в сочетании с адекватной инфузионной терапией3;
- начинать введение следует с низких доз, подбирая оптимальную дозу для конкретного пациента с помощью инфузомата под тщательным контролем артериального давления, электрокардиограммы, общего состояния1;
- болюсные введения проводятся с осторожностью из-за высокого риска развития гипертензии, аритмий;
- период полувыведения очень короткий (всего несколько минут), поэтому ни в коем случае нельзя допускать прерывания инфузии при транспортировке пациента, следует заблаговременно подготавливать разведенный препарат на замену тому, который может скоро закончиться;
- повышение артериального давления не означает, что тканевая перфузия тоже улучшилась, чаще всего она даже снижается. В связи с этим длительность применения следует по возможности сокращать3.
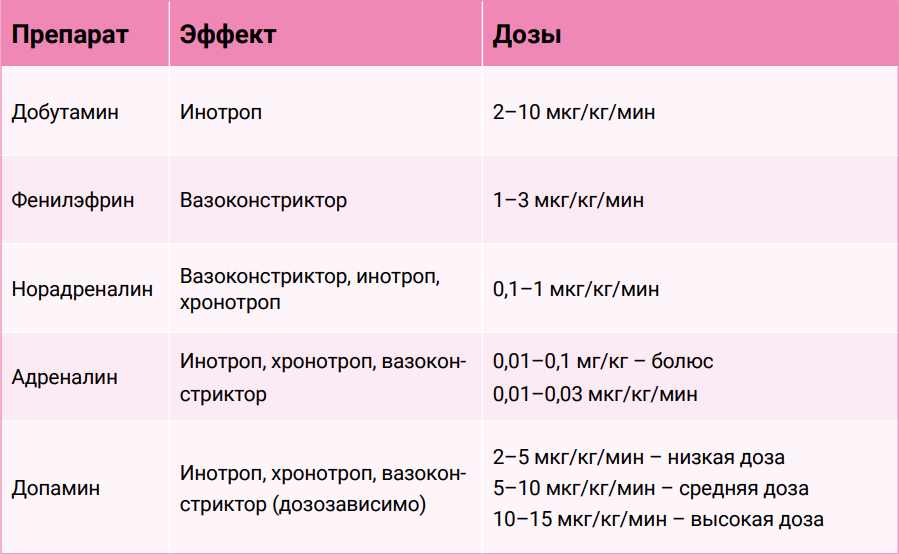
Фенилэфрин (мезатон) – мощный и селективный агонист α1-адренорецепторов. Введение фенилэфрина вызывает вазоконстрикцию гладких мышц артерий (увеличивается периферическое сосудистое сопротивление) и веноконстрикцию (снижается венозная емкость и увеличивается венозный возврат). Резкое повышение артериального давления из-за введения мезатона активирует артериальный барорефлекс, что вызывает рефлекторное повышение активности блуждающего нерва и снижение частоты сердечных сокращений. Фенилэфрин полезен для лечения гипотензии, опосредованной вазодилатацией, и используется аналогично норадреналину5.
Важно использовать препарат с осторожностью: не допускать развития гипертензии, потому что это может привести к вазопрессорной зависимости. При этом жидкость из кровотока перемещается в ткани под действием высокого давления, происходит гиповолемия и возрастает потребность в вазопрессорах. Такое состояние корректируется усилением инфузионной терапии и снижением α1-агонистов.
Норадреналин активирует все 4 типа адренорецепторов, однако β2 – в значительно меньшей степени, чем остальные. Влияние наиболее выражено на α1-адренорецепторы и зависит от дозы. Механизм повышения артериального давления заключается в комбинации сосудистого (α-адренорецептор-опосредованная вазоконстрикция) и сердечного (увеличение сердечного выброса за счет активации β1-адренорецепторов) эффектов7. Назначают норадреналин для лечения гипотензии при шоковых состояниях (например, при сепсисе), а также он очень полезен во время анестезии вместо дополнительного увеличения количества вводимой жидкости внутривенно, когда высок риск перегрузки жидкостью.
Интересный факт: норадреналин вызывает выраженную вазоконстрикцию сосудов кожи, что в сочетании с гипотензией и длительным позиционным давлением на ограниченные участки тела может вызывать ишемические поражения. Соблюдайте осторожность, перекладывайте таких пациентов и используйте мягкие подстилки2.
Адреналин является мощным агонистом α-адренергических (α1 и α2) и β-адренергических (β1 и β2) рецепторов. Вызывает вазоконстрикцию и уменьшает кровоток в сосудистых руслах, содержащих высокие концентрации α1-адренорецепторов (например, во внутренних органах, сосудах кожи), при этом вызывает расслабление сосудов, содержащих и α1, и β2-адренорецепторы (например, сосуды скелетных мышц). Это объясняет отсутствие длительной рефлекторной брадикардии, поскольку в результате действия адреналина повышается систолическое давление, при этом показатели среднего давления могут остаться на том же уровне или повыситься незначительно. Адреналин выраженно влияет на β1-адренорецепторы и увеличивает сократимость сердца, частоту сердечных сокращений и сердечный выброс1. Обычно его назначают при опасных для жизни состояниях, таких как тяжелая гипотензия, анафилактический шок или остановка сердца5.
Адреналин чаще всего не используют для лечения гипотензии во время анестезии, так как при этом высок риск возникновения аритмий.
Препарат можно вводить внутривенно, внутрикостно, через эндотрахеальную трубку в виде болюса во время проведения реанимации.
Механизм противоаллергенного действия адреналина при анафилаксии заключается в расширении бронхов, торможении высвобождения медиаторов воспаления (гистамина, серотонина, кининов и др.) из тучных клеток и вазоконстрикции.
Интересный факт: α-рецепторы легче стимулируются норадреналином по сравнению с адреналином, а β-рецепторы легче стимулируются адреналином по сравнению с норадреналином. Это различие объясняется расположением рецепторов и их преимущественной активацией нервным (норадреналин) или гуморальным (адреналин) путем3.
Допамин – непосредственный метаболический предшественник норадреналина, естественным образом встречается в ЦНС в базальных ганглиях, где он действует как нейротрансмиттер, а также в мозговом веществе надпочечников. В низких дозах он влияет на дофаминергические рецепторы и расширяет кровеносные сосуды в сердце, почках, брыжейке; в умеренных – повышает сократимость сердца за счет β1-адренергических эффектов; в высоких дозах стимулирует α1-адренорецепторы и вызывает вазоконстрикцию, при этом увеличивается риск возникновения тахикардии и желудочковых аритмий из-за повышения возбудимости миокарда4. В результате допамин можно использовать как инотроп или вазопрессор в зависимости от скорости инфузии. Клинический эффект проявляется через 5–10 минут после начала введения. Его применяют при шоковых состояниях, острой сердечной недостаточности и для коррекции артериального давления во время анестезии.
Интересный факт: экстравазация допамина вызывает некроз и отторжение окружающих тканей вследствие ишемии тканей. Если происходит экстравазация, рекомендовано ввести в пораженное место раствор 5–10 мг фентоламина, разведенного в 10–15 мл физиологического раствора с помощью шприца с тонкой иглой, это быстро расширит сосуды и минимизирует последствия1.
Заключение
Симпатомиметики – препараты, которые применяются в тяжелых клинических ситуациях. Их подбор индивидуален и требует понимания патогенеза. При работе с симпатомиметиками необходимо точно титровать дозу и внимательно контролировать общее состояние пациента. Надеюсь, что данная статья поможет читателю разобраться в этой сложной теме и облегчит клиническую работу.Список литературы:
- Allerton F. Small Animal Formulary 10th edition – Part A: Canine and Feline // BSAVA, 2020. – 512 p.
- Cumming S., Martinez-Taboada F., McDonald B., Martinez N. Suspected norepinephrine-associated skin slough in a dog with sepsis //Australian Veterinary Practitioner, 49(4): 99–104, January2020.
- Duke-Novakovski T., Marieke de Vries, Seymour C. BSAVA Manual of Canine and Feline Anaesthesia and Analgesia. Third edition // BSAVA, 2016. – 464 p.
- Papich M. G. Saunders Handbook of Veterinary Drugs: Small and Large Animals (4th ed.). St Louis, MO: Elsevier, 2016.
- Pascoe P. J., Ilkiw J. E., and Pypendop B. H. Effects of increasing infusion rates of dopamine, dobutamine, epinephrine, and phenylephrine in healthy anesthetized cats. American Journal of Veterinary Research, 67(9): 1491–1499, September 2006.
- Riviere J. E., Papich M. G. Veterinary Pharmacology and Therapeutics. Tenth Edition // John Wiley & Sons, Inc., 2018. – 1525 p.
- Romich J. A. Fundamentals of Pharmacology for Veterinary Technicians, 3rd Edition // Cengage Learning, 2020. – 942 p.
- Rosati M., Dyson D. H., Sinclair M. D., Sears W. C. Response of hypotensive dogs to dopamine hydrochloride and dobutamine hydrochloride during deep isoflurane anesthesia. Am J Vet Res, 68(5): 483–494, May 2007.
- Whalen K., Field C., Radhakrishnan R. Lippincott Illustrated Reviews: Pharmacology. 7th Edition // Lippincott Williams & Wilkins, 2018. – 576 p.


 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург