Введение
Эпидуральная анестезия (ЭА) в ветеринарии, как и в гуманной медицине, занимает одно из ведущих мест в структуре анестезиологического обеспечения в самых различных областях хирургии: абдоминальной, торакальной, травматологии и ортопедии, оперативной урологии и гинекологии, а также в акушерстве. На текущий момент в гуманной медицине описаны успешные результаты применения ЭА при операциях на позвоночнике и спинном мозге. При этом не существует литературных и иных данных о проведенных исследованиях по применению указанного вида анестезии мелким домашним животным со спинальной патологией. Однако упоминания об относительных противопоказаниях к проведению ЭА у пациентов с патологиями позвоночника продолжают встречаться как в ветеринарной, так и в гуманной медицине.Авторы публикаций отмечают, что существующие патологические изменения позвоночника и элементов позвоночного канала могут затруднять пункцию и идентификацию эпидурального пространства, влиять на распространение анестетика по эпидуральному пространству, создавать основу для увеличения числа осложнений и случаев неэффективной блокады спинномозговых корешков7. Также Luis Campoy & Matt R. Read не рекомендуют применять ЭА для пациентов с существовавшими ранее неврологическими нарушениями в блокируемой области, обосновывая этот факт затруднением определения причин возможного ухудшения неврологического дефицита (осложнения после ЭА или прогрессирование истинной патологии)7.
Комментируя первое противопоказание, можно отметить, что проводить ЭА пациентам с патологическими изменениями позвоночника должен врач с наибольшим опытом работы в этой области и следует использовать этот метод анальгезии не в монорежиме, а только в комбинированной анестезии.
По поводу второго противопоказания авторы ссылаются на те исследования, в которых описаны осложнения после использования ЭА10,11,12. Упоминается, что данные осложнения могут встречаться при длительном контакте раздражающего вещества (местного анестетика, МА) с нервными корешками и спинным мозгом (СМ) вследствие использования высоких доз и концентраций, при добавлении вазоконстрикторов, а также при несоблюдении правил асептики и антисептики, что способствует проникновению бактерий в эпидуральный канал. Применяя на практике правильную технику выполнения ЭА, соблюдая правила асептики и антисептики и используя рекомендованные дозы и концентрации МА, врач максимально минимизирует риск развития осложнений, связанный с пункцией эпидурального пространства (ЭП).
Следует отметить, что общая анестезия (ОА) также может привести к ухудшению ранее существовавшего неврологического дефицита по причине патологии позвоночника или СМ. Ухудшения в данном случае будут связаны с недостаточной доставкой кислорода к тканям патологических участков СМ в условиях ОА. Основными причинами недостаточной доставки кислорода считаются гипотензия и гипоксия, однако при этом мы не отказываемся проводить ОА пациентам с ранее существовавшим неврологическим дефицитом.
Хочется еще раз подчеркнуть, что перечисленные противопоказания являются относительными.
Они встречаются далеко не в каждой книге, и последние наиболее свежие упоминания, которые автор статьи смогла найти, были описаны в 2013 году (Luis Campoy и Matt R. Read)7. При этом некоторые исследователи (Grimm K. A. et al., 2015; Lerche P. et al., 2016; Otero P. E., Portela D. A., 2019) пишут в своих публикациях только об абсолютных противопоказаниях к использованию ЭА, таких как гиповолемия/гипотензия, гипокоагуляция/тромбоцитопения и инфекции/новообразования кожи в местах выполнения пункций.
Обзор литературы
Наиболее полное исследование по применению регионарной анестезии в хирургии позвоночника было проведено в нашей стране на базе НИИ нейрохирургии им. Н. Н. Бурденко РАМН, г. Москва2. В данном исследовании больных разделили на 2 группы: представители первой группы были прооперированы в условиях ЭА с использованием местных анестетиков (МА), а представители второй группы – в условиях ОА. Наибольший интерес представляла динамика артериального давления (АД) и частоты сердечных сокращений (ЧСС) на третьем этапе исследования, который характеризовался высокой травматичностью (смещение дурального мешка и тракция спинномозгового корешка). Были получены статистически достоверные различия (р < 0,05) между группами, причем в первой группе больных было отмечено дальнейшее снижение величин систолического, диастолического и среднего АД при неизменных значениях ЧСС, тогда как во второй группе величины систолического и среднего АД повышались по сравнению с предыдущим этапом. Увеличилась и ЧСС, хотя отличие было статистически незначимым. Такая реакция гемодинамических параметров, по мнению авторов, свидетельствует о недостаточной защите организма оперируемого больного от ноцицептивной стимуляции на этом этапе в условиях ОА. Отмечалась эффективность послеоперационного обезболивания у первой группы больных. Болевые ощущения спустя 2 часа после операции практически отсутствовали у больных с ЭА, а у пациентов из второй группы отмечался достаточно интенсивный болевой синдром. В течение 1–2 суток после операции у больных в группе с ЭА отмечался незначительный дискомфорт в области операционной раны при изменении положения тела, а пациенты из группы ОА ощущали боль средней интенсивности в покое и при изменении положения тела, которая лишь кратковременно купировалась анальгетиками.Исследование А. А. Ежевской1 (ФГУ «Нижегородский научно-исследовательский институт травматологии и ортопедии Росмедтехнологий») 2010 года показало наличие статистически значимого уменьшения объема интраоперационной кровопотери (в 2 раза) в группе с ЭА (ропивакаин + фентанил) по сравнению с контрольной (ОА). Расход препаратов (фентанила и севофлурана) во время проведения анестезии в контрольной группе был достоверно больше, а также у пациентов в контрольных группах на этапах наибольшей травматичности отмечалось статистически значимое повышение САД, среднего АД, сердечного индекса, индекса системного сосудистого сопротивления на 15-25%.
Исследование, проведенное в Индии и опубликованное в «Журнале клинических и диагностических исследований» (англ. Journal of Clinical and Diagnostic Research) в 2016 году5, позволило выявить, что добавление дексмедетомидина к ропивакаину является эффективным для упреждающей эпидуральной анальгезии при операциях на пояснично-крестцовом отделе позвоночника. В группе пациентов, которым был добавлен дексмедетомидин, средние баллы по визуально-аналоговой шкале оценки боли были значительно ниже в течение 12 часов в послеоперационном периоде по сравнению с представителями группы, которым при проведении ЭА вводили только ропивакаин.
Еще одно индийское исследование, опубликованное в «Азиатском журнале исследований позвоночника» (Asian Spine Journal) в 2017 году3, позволило выявить у больных, которым делали ЭА ропивакаином, лучшее качество обезболивания в послеоперационном периоде по сравнению с пациентами контрольной группы, в которой не проводилась ЭА. Также по сравнению с контрольной группой больные из исследуемой группы в интраоперационном периоде имели меньшую потребность в фентаниле и более ранней мобилизации.
В 2018 году Aglio с соавторами опубликовали исследование в «Журнале нейрохирургии позвоночника» (англ. Journal of Neurosurgery Spine) о воздействии упреждающей анальгезии на характер послеоперационной боли при операциях на грудо-пояснично-крестцовом отделе позвоночника4. Авторы выявили у больных, которым была проведена ЭА с использованием гидроморфона и комбинации бупивакаина с гидроморфоном, низкую потребность в опиоидных препаратах в послеоперационном периоде по сравнению с контрольной группой.
Цель
На сегодняшний день такие операции, как декомпрессия спинного мозга, стали рутинными в ветеринарии мелких домашних животных. Традиционно при проведении таких операций применяются различные методики общей анестезии с использованием как ингаляционных, так и внутривенных анестетиков. При этом очевидно, что регионарная анестезия является идеальным средством обезболивания, которое будет способствовать снижению потребности в опиоидных препаратах или иных системных анальгетиках, а также существенному снижению побочных реакций последних на сердечно-сосудистую и респираторную системы. С более подробной информацией о сравнении методов анальгезии посредством проведения регионарной анестезии и ОА можно ознакомиться в статье нашей коллеги Зубановой Е. «Опиоиды или местные анестетики?» (журнал «Ветеринарный Петербург» № 1/2022 г.).Целью данной статьи является демонстрация возможностей применения эпидуральной анестезии, ее эффективности и безопасности в периоперационном периоде у пациентов с болезнью межпозвонковых дисков грудного и поясничного отделов позвоночника, дегенеративным люмбосакральным стенозом, а также с опухолевым поражением спинного мозга, спинномозгового корешка или позвонков у мелких домашних животных.
Материал и методы
В 2021 году автором данной статьи были выполнены эпидуральные блокады в рамках комбинированной анестезии у 12 собак при операциях на позвоночнике. У пяти собак из 12 были проведены декомпрессия корешков спинного мозга на уровне L7-S1 и установка транспедикулярных фиксаторов, у шести собак – декомпрессия спинного мозга в грудном и поясничном отделах, вызванная дегенеративной болезнью дисков, и у одной собаки – корпэктомия в грудном отделе позвоночника по причине наличия новообразования спинного мозга. Предоперационная неврологическая симптоматика включала болевой синдром разной степени интенсивности в области спины, нарушения чувствительности в тазовых конечностях и преходящие нарушения функций тазовых органов. Возраст пациентов колебался от 4 до 14 лет, вес – от 3 до 67 кг. Физический статус у всех прооперированных собак оценивался как II-III класс по классификацииASA, что свидетельствует об умеренных анестезиологических рисках.Все пациенты получали внутривенную индукцию анестезии с введением диазепама (от 0,25 до 0,5 мг/кг), пропофола (от 2 до 8 мг/кг) и фентанила (2 мкг/кг); 11 собакам из 12 также был введен кетамин (1 мг/кг, в/в), а трем собакам из 12 – лидокаин (1 мг/кг, в/в). Поддержание анестезии осуществлялось с помощью газового анестетика изофлурана (0,5–2,5 об.%), инфузии фентанила с постоянной скоростью (ИПС в минимальной дозе 2 мкг/кг/ч). Также 3 собаки получили ИПС лидокаина (30 мкг/кг/мин) и кетамина (0,5 мг/кг/ч, в/в). Среднее время операций составило 61 минуту.
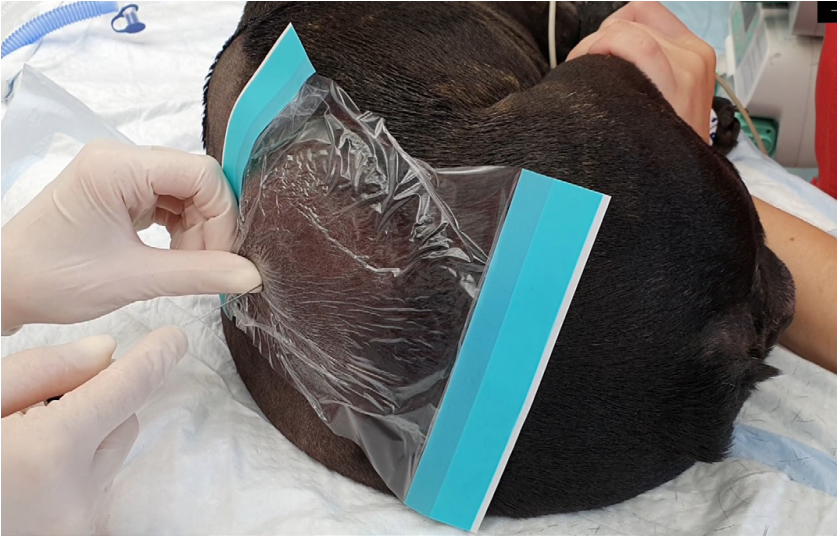
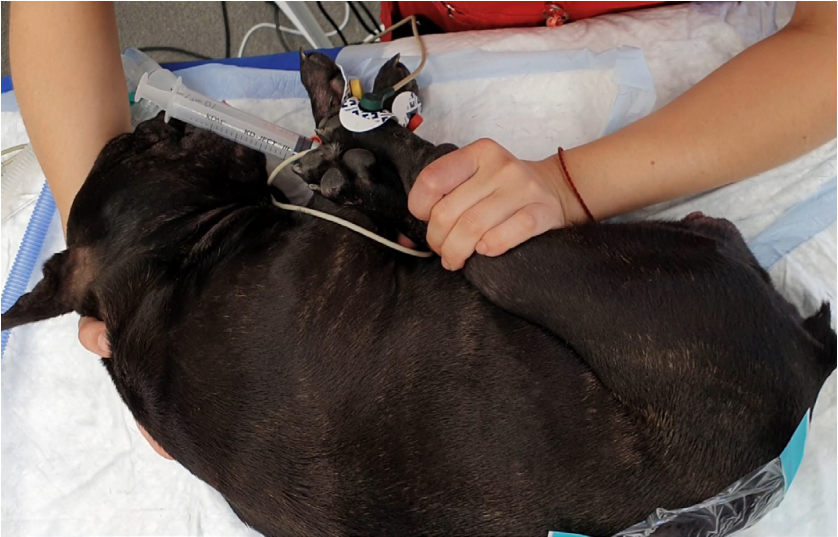
ЭА выполнялась в условиях операционной при полноценном мониторинге основных показателей жизнедеятельности пациента (ЭКГ, SpO2, АД, ЧДД, EtCO2). В асептических условиях (стрижка шерсти с помощью триммера, обработка кожи мыльным раствором, обработка кожным антисептиком, стерильное поле/стерильная инцизная пленка, стерильные перчатки, хирургические шапочка и маска; рис. 1) и в положении пациента на боку (с максимально отведенными тазовыми конечностями краниально, а грудными конечностями – каудально; рис. 2) выполнялась пункция эпидурального пространства чаще всего на 1–3 межпозвонковых промежутка краниальнее или каудальнее предполагаемого разреза с использованием стандартной техники и одноразовых спинальных игл типа Квинке (англ. Quincke) 22 или 25 G (KDM, Германия).
Выбор места пункции определялся не только на основании предполагаемой области хирургического доступа, но и с учетом отсутствий инфицирования кожи и каких-либо новообразований в области пункции, а также патологий СМ и позвоночника, подтвержденных с помощью МРТ (компрессия, воспаление, отек), в области пункции. Последний параметр является немаловажным, поскольку мы достоверно не знаем, приведет ли пункция ЭП в месте, где ранее была патология, к каким-либо осложнениям в будущем. Для идентификации ЭП использовалась методика «утраты сопротивления».
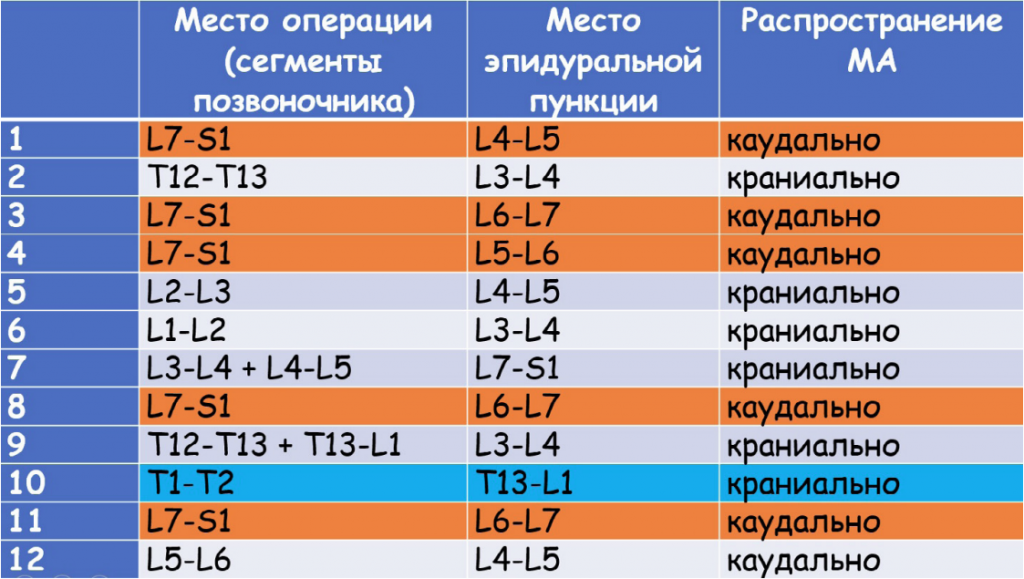
Во время декомпрессии корешков СМ в области L7-S1 место пункции ЭП у трех собак было выбрано между L6-L7 поясничными позвонками, у одной собаки – между позвонками L5-L6 и еще у одной – между L4-L5 (МА вводился каудально). При декомпрессии СМ в поясничном и грудном отделах пункция осуществлялась чаще всего в области L3-L4, и МА вводился краниально (рис. 3).
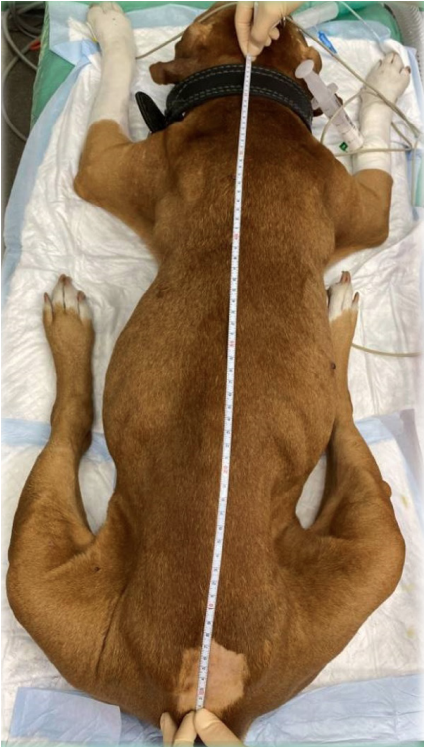
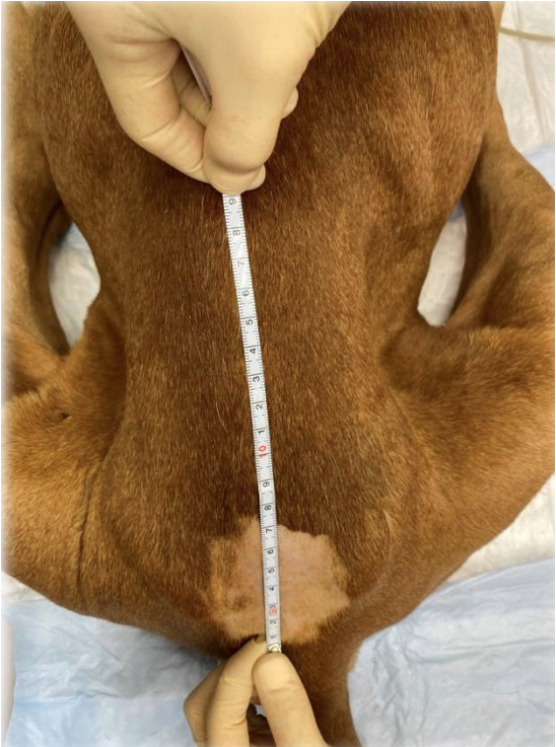
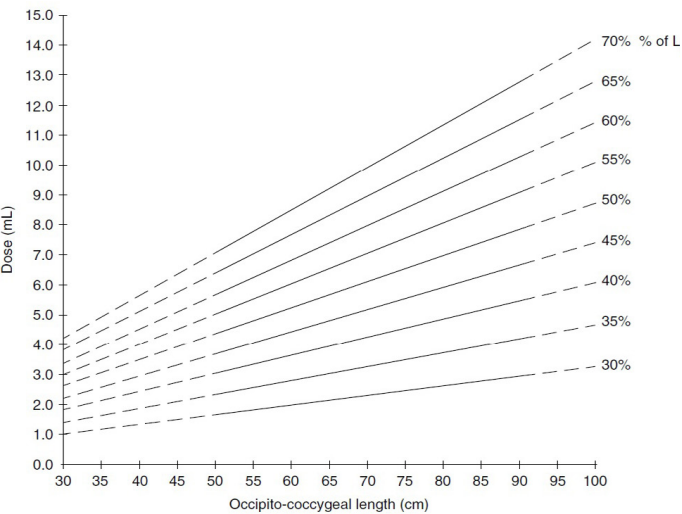
В качестве МА использовались 0,5%-ный раствор бупивакаина и 1–2%-ный раствор лидокаина, как по отдельности, так и в комбинации друг с другом. У 10 собак к раствору МА были добавлены опиоиды (морфин 0,1% или фентанил 0,05%). Дозы МА не превышали максимально допустимые для эпидурального введения (бупивакаин – 0,5% не более 1 мг/кг, лидокаин – 2% не более 4 мг/кг), а дозы опиоидов соответствовали рекомендованным для эпидурального введения (морфин – 0,1 мг/кг, фентанил – 1–5 мкг/кг). Объем ЭА был рассчитан с помощью диаграммы взаимосвязи между дозой (объем вводимого препарата, мл), измеренным затылочно-копчиковым расстоянием (см) и желаемым распределением контрастного вещества (% OCL)6 (рис. 4-6). Сенсорный и моторный блок развивались через 20–30 минут.
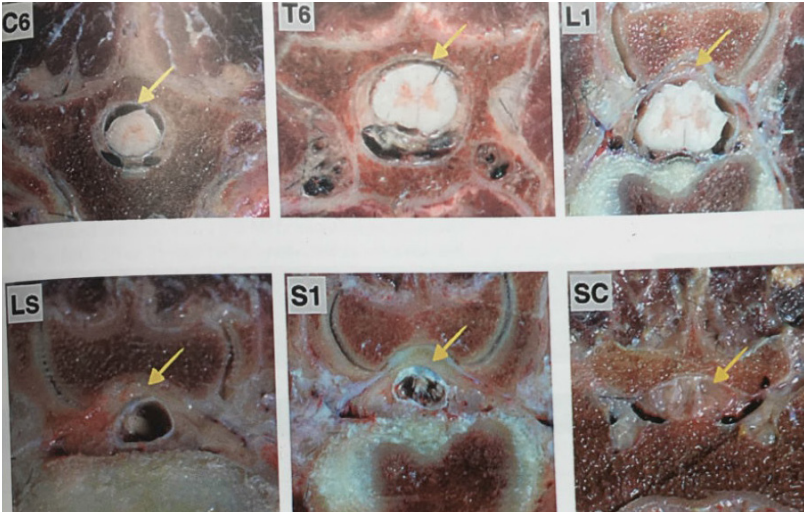
Данная диаграмма описана для собак со стандартной пункцией в пояснично-крестцовой области и измеренной длиной спины в положении пациентов лежа на груди. Известно, что объем ЭП в разных сегментах СМ различается (рис. 7). Так, объем ЭП в шейном и грудном отделах позвоночника намного меньше по сравнению с пояснично-крестцовым отделом. В связи с этим, осуществляя пункцию ЭП в иной области, возможно, пользоваться расчетами данной диаграммы будет некорректно. Также была описана формула расчета объема МА для блокады 35% длины спины (T4-L3) при проведении пункции в области L1-L2 – 0,05 мл/см OCL (Otero P. E. & Portela D. A.)6.
При осуществлении пункции в пояснично-крестцовой и крестцово-хвостовой областях описаны формулы для блокады 30–35% длины спины – 0,05 мл/см OCL, 55–60% длины спины – 0,1 мл/см OCL, 70–75% длины спины – 0,15 мл/см OCL.
В ходе анестезии и операции проводился мониторинг ЭКГ во втором отведении, систолического, среднего и диастолического АД, пульсовой оксиметрии (SpO2), капнометрии (EtCO2) и термометрии. В случае повышения ЧСС или АД более чем на 20% от исходных значений во время хирургического вмешательства животным внутривенно вводились болюсы фентанила (0,05% в дозе 1 мкг/кг). Такая реакция гемодинамических параметров чаще всего связана с ноцицептивной стимуляцией. В итоге из 12 собак дополнительные болюсы фентанила потребовались только в 50% случаев. Пяти собакам было достаточно однократного болюса, который требовался чаще всего в первые пять минут операции, во время хирургического доступа. Одной собаке потребовались два болюса фентанила в середине операции, что, вероятно, было связано с неравномерным распределением анестетика в оперируемом сегменте СМ.
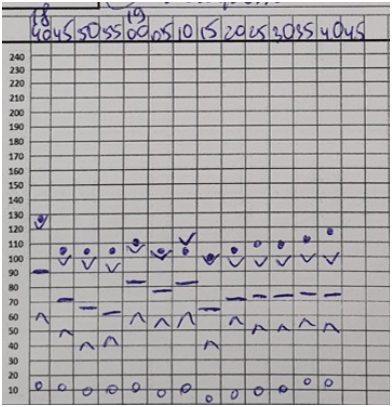
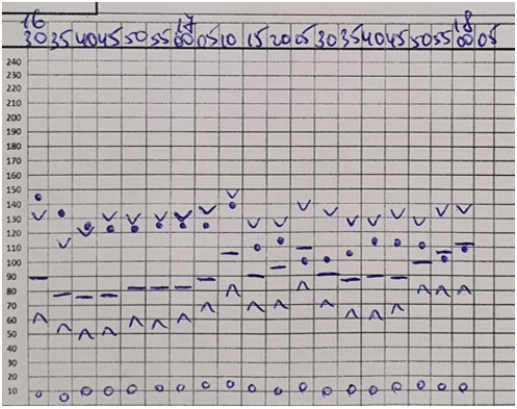
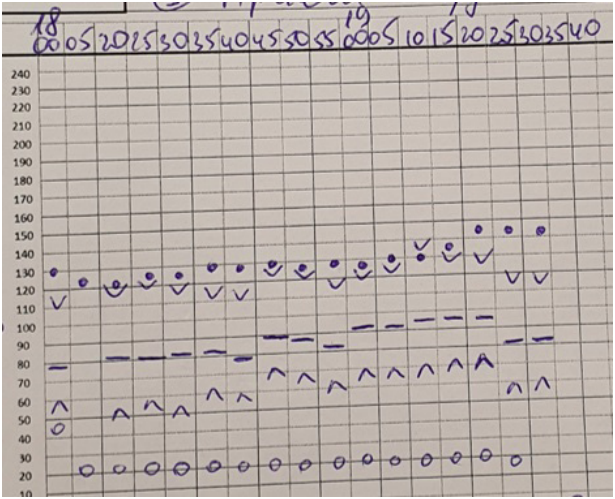
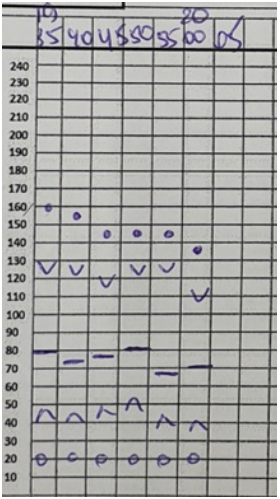
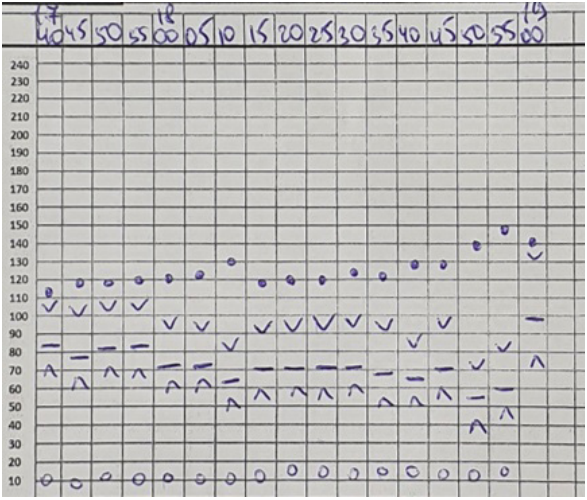
Во время операций проводилась запись всех гемодинамических параметров каждые 5 минут по трендам, позволяющим косвенно судить о том, что пациентам было обеспечено достаточно хорошее качество анальгезии (рис. 8-13).
В послеоперационном периоде использовались нестероидные противовоспалительные препараты. Пробуждение и экстубация у всех собак были быстрыми – в течение первых 10 минут после окончания операции. Болевые ощущения оценивались субъективно посредством ответа на пальпацию в области хирургической раны и поведенческих реакций в течение первых двух часов после операции. Болевые ощущения при пальпации у пациентов практически отсутствовали, а поведенческие реакции не отличались от таковых до операции (рис. 14, 15). Не было выявлено агрессии, вылизывания раны, вокализации, ажитации, тахипноэ, одышки, тахикардии и гипертензии.
Результаты и их обсуждение
Пункция ЭП в нестандартном месте технически выполняется немного сложнее. Успех проведения ЭА зависит от положения пациента и правильного подбора спинальной иглы.К сожалению, точного метода определения необходимого объема МА при пункции ЭП в нестандартных местах на данный момент нет.
Расход внутривенных препаратов для обезболивания во время анестезии у пациентов с применением ЭА был значительно ниже, чем у тех, кого мы ранее оперировали без применения данного метода регионарной анестезии. Дозы фентанила для индукции в последних случаях составляли обычно от 2 до 4 мкг/кг с дальнейшей ИПС в дозе 4–10 мкг/кг/ч, также иногда выполнялось болюсное введение фентанила в дозе 1 мкг/кг. Соответственно, дозы фентанила в условиях комбинированной анестезии снижались как минимум в 2 раза.
Компрессии СМ и корешков СМ могут оказывать влияние на неравномерное распространение анестетика по эпидуральному каналу, вследствие чего может наступить неполная сенсорная блокада оперируемой области. В связи с этим использовать ЭА в монорежиме в качестве единственного метода обезболивания не следует.
В послеоперационном периоде пациенты, которые во время операции получали наркотические или сильнодействующие средства длительно или в больших количествах, как правило, в ближайшем послеоперационном периоде находились в состоянии ажитации, что не наблюдалось у описанных выше 12 собак.
Выводы
Эпидуральная анестезия, осуществляемая на уровне грудного, поясничного или пояснично-крестцового отдела позвоночника повышает эффективность и безопасность анестезиологического пособия и послеоперационного обезболивания при травматичных операциях на позвоночнике.Фармакологическая нагрузка на пациентов уменьшается за счет значительного снижения доз опиоидных и иных анестетиков, что приводит к уменьшению побочных реакций последних со стороны сердечно-сосудистой и дыхательной систем, а также способствует быстрому пробуждению животных. Эффективность послеоперационного обезболивания субъективно лучше по сравнению с внутривенной анальгезией, что способствует ранней мобилизации пациентов (рис. 16, 17).
Для получения статистически достоверных сведений о лучшем уровне обезболивания в интраоперационном периоде в ближайшем будущем планируется проведение проспективного исследования на базе «Ветеринарной клиники неврологии, травматологии и интенсивной терапии», а для получения объективных данных о послеоперационном обезболивании будет приобретен альгометр.
Литература:
- Ежевская А. А. Анестезиологическое обеспечение высокотравматичных операций на позвоночнике // Медицинский альманах. – 2010. – № 2.
- Соленкова А. В. и др. Эффективность и безопасность эпидуральной анестезии при операциях на позвоночнике // Москва – Тверь. – 2004. – С. 229–238.
- Kumar S., Palaniappan J. M., Kishan A. Preemptive caudal ropivacaine: an effective analgesic during degenerative lumbar spine surgery // Asian spine journal. – 2017. – Т. 11. – № 1. – С. 113.
- Aglio L. S. et al. Preemptive analgesia for postoperative pain relief in thoracolumbosacral spine operations: a double-blind, placebo-controlled randomized trial // Journal of Neurosurgery: Spine. – 2018. – Т. 29. – № 6. – С. 647–653.
- Kalappa S., Sridhara R. B., Kumaraswamy S. Dexmedetomidine as an adjuvant to pre-emptive caudal epidural ropivacaine for lumbosacral spine surgeries //Journal of clinical and diagnostic research: JCDR. – 2016. – Т. 10. – № 1. – С. UC22.
- Otero P. E., Portela D. A. Manual of small animal regional anesthesia: Illustrated anatomy for nerve stimulation and ultrasound-guided nerve blocks. – 5M Publishing, 2019.
- Campoy L., Read M. R. (ed.). Small animal regional anesthesia and analgesia. – John Wiley & Sons, 2013.
- Lerche P. et al. Handbook of small animal regional anesthesia and analgesia techniques. – John Wiley & Sons, 2016.
- Grimm K. A. et al. (ed.). Veterinary anesthesia and analgesia. – John Wiley & Sons, 2015.
- Aldrete J. A. Neurologic deficits and arachnoiditis following neuroaxial anesthesia. Acta Anaesthesiol Scand, 47: 3–12, 2003.
- MacFarlane P. D., Iff I. Discospondylitis in a dog after attempted extradural injection. Vet Anaesth Analg, 38: 272–273, 2011.
- Remedios A. M., Wagner R., Caulkett N. A. et al. Epidural abscess and discospondylitis in a dog after administration of a lumbosacral epidural analgesic. Can Vet J, 37: 106–107, 1996.



 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург