Введение
Одонтогенные абсцессы встречаются у морских свинок (Cavia porcellus) достаточно часто и представляют значительную сложность для ветеринарных врачей в связи с небольшими размерами пациентов и особенностями анатомического строения зубочелюстного аппарата.Интраоральное удаление щечных зубов (особенно каудальных моляров) у морских свинок может быть сопряжено с высоким риском перелома резервной коронки во время попытки экстракции, однако без устранения причины полностью вылечить животное в большинстве случаев невозможно. Также существуют особенности применения противомикробных средств у морских свинок: следует избегать назначения антибиотиков, селективно влияющих на грамположительную микрофлору, в связи с риском развития фатальной клостридиозной энтеротоксемии, кроме случаев, когда только конкретный препарат может быть использован по результатам бактериологического посева при отсутствии более безопасной альтернативы11.
На сегодняшний день достоверно не известны причины развития приобретенной дентальной болезни у грызунов и кроликов. Предполагают мультифакторную этиологию, включающую неправильную диету (избыток высокоэнергетических кормов с недостатком грубой клетчатки, недостаточные абразивные свойства кормов) и генетическую предрасположенность9. Также, вероятно, предрасполагающими факторами для морских свинок являются гиповитаминоз С (нарушение формирования дентина), гипокальциемия (дефицит кальция в рационе может приводить к фиброзной остеодистрофии5), недостаток или избыток селена и гиповитаминоз А.
Особенности анатомии
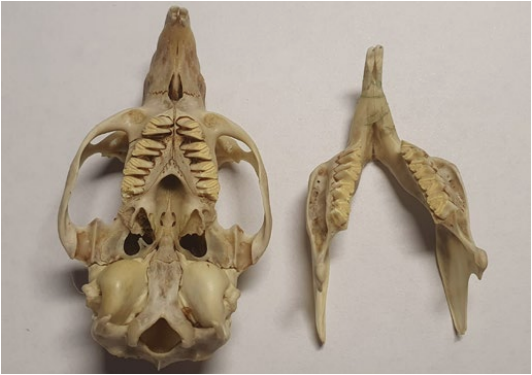
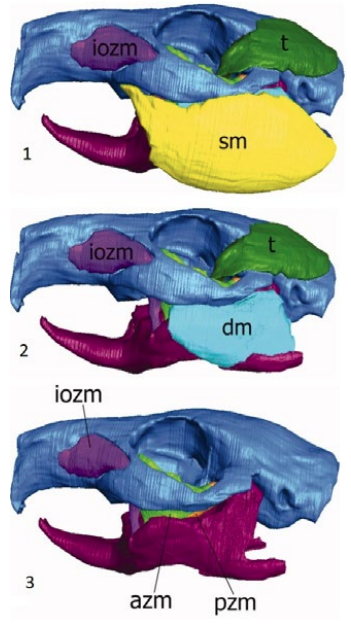
Все зубы у морских свинок являются элодонтными арадикулярными (продолжают расти в течение всей жизни, анатомического корня не формируют), на каждой челюсти расположены 3 моляра, 1 премоляр и 1 резец, клыки отсутствуют (фото 1). Дентальная формула морской свинки: 2(I 1/1, C 0/0, P 1/1, M 3/3), всего 20 зубов. Резервные коронки имеют изгиб, и окклюзионные поверхности щечных зубов располагаются под углом примерно 30° дорсобуккально и вентролингвально на верхней и нижней челюстях соответственно (фото 2).В отличие от декоративных кроликов у морских свинок отсутствует жевательная ямка (masseteric fossa) на нижней челюсти. Жевательная мышца (musculus masseter) очень хорошо развита, состоит из 3 слоев (поверхностный, средний и глубокий), и ее проксимальная точка прикрепления располагается над всей скуловой дугой (инфраорбитальная зигоматико-массетерная часть) (фото 3). Массетер покрывает латеральную поверхность тела нижней челюсти, ее ветвь и угловой отросток.
iozm – инфраорбитальная часть m. zygomaticomandibularis;
azm – передняя часть m. zygomaticomandibularis;
pzm – задняя часть m. zygomaticomandibularis;
sm – поверхностный слой m. masseter;
dm – глубокий слой m. masseter;
t – височная мышца.
Патофизиология формирования одонтогенного абсцесса
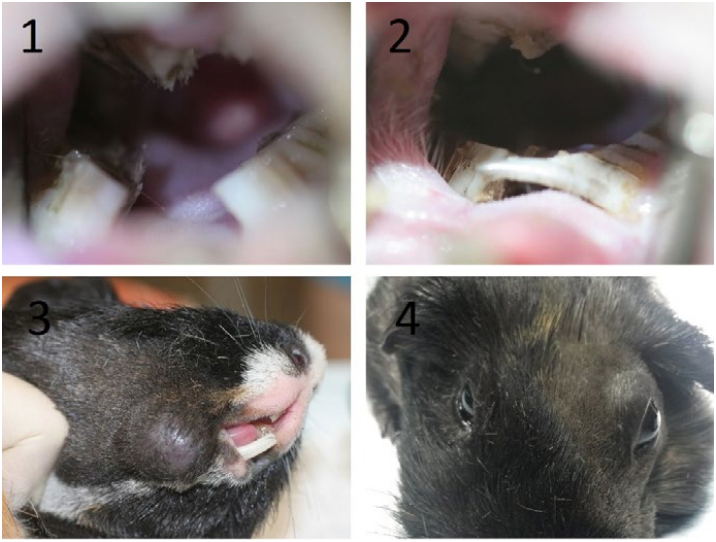
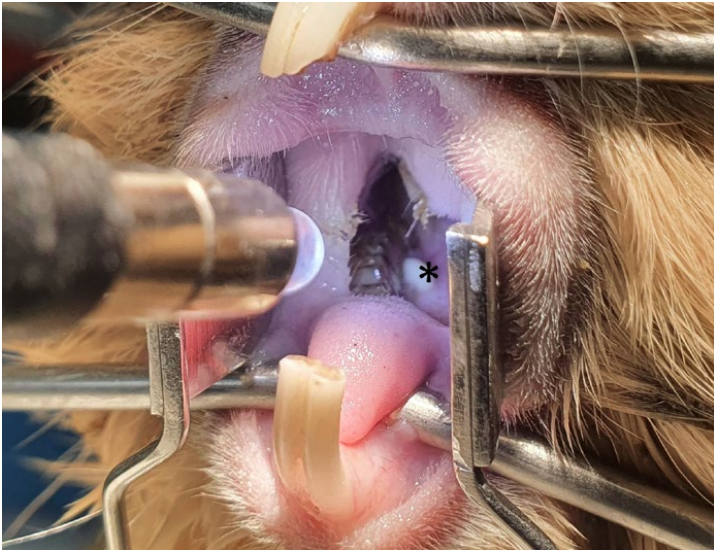
Если скорость роста зубов превосходит скорость их стирания (например, при диете с недостатком грубой клетчатки), происходит удлинение клинических коронок зубов, при этом челюсти не могут сомкнуться и закономерно повышается окклюзионное давление. В определенный момент сила массетера останавливает дальнейшее удлинение клинических коронок, а поскольку окклюзионное давление остается высоким, начинается удлинение резервных коронок и смещение апексов. При этом наблюдается деформация кортикальной кости и иногда ее перфорация (приобретенная дентальная болезнь 2-й стадии). При ослаблении силы массетера из-за постоянного натяжения происходит элонгация клинических коронок (приобретенная дентальная болезнь 3-й стадии), и часто наблюдается смещение одной из нижних челюстей латерально с подвывихом височно-нижнечелюстного сустава. Параллельно развивается периодонтит, который осложняет течение болезни. В дальнейшем может развиться периапикальная инфекция, фокальный остеомиелит и абсцесс (приобретенная дентальная болезнь 5-й стадии).В отличие от других грызунов и кроликов для морских свинок характерно формирование так называемого «моста» («арки») над языком при элонгации Р4 и М1 (приобретенная дентальная болезнь 3-й стадии). При периодонтите часто наблюдается аккумуляция шерсти в периодонтальных карманах (фото 4.1). Элонгация резцов у морских свинок практически всегда вторична по отношению к элонгации щечных зубов и ростральному смещению нижней челюсти.
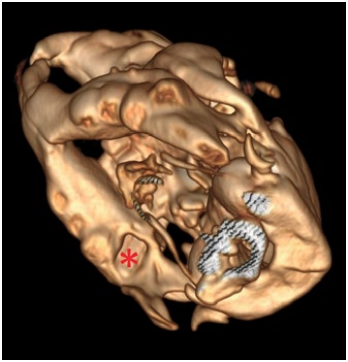
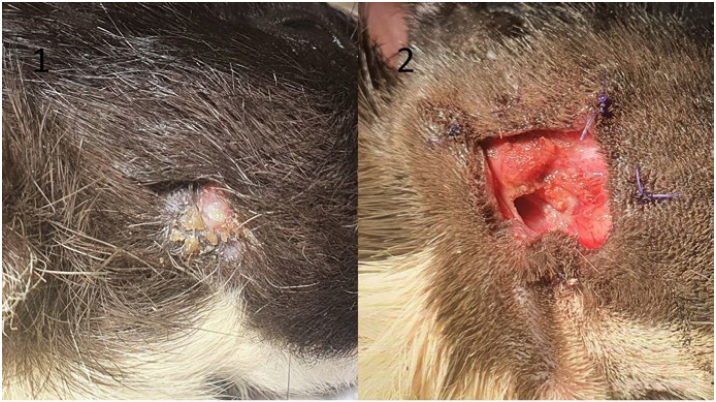
С учетом анатомии большинство одонтогенных абсцессов нижней челюсти располагаются под жевательной мышцей (ретромассетерные [retromasseteric])14. Часто абсцессы залегают очень глубоко и имеют несколько камер. Кожа над абсцессом может быть гиперемированной, без шерсти или с признаками некроза. Иногда на момент обращения в клинику у пациента уже имеется нарушение целостности кожи над абсцессом с формированием фистулы (фото 9.1.)3. Гной может быть любой консистенции, однако чаще всего казеозный.
При периапикальной инфекции последнего мандибулярного моляра (М3) абсцесс иногда располагается на медиальной (фото 6) или одновременно на медиальной и латеральной поверхностях челюсти. Поскольку мыщелковый отросток очень короткий, гнойное воспаление может быстро перейти на височно-нижнечелюстной сустав15.
Клинические признаки
У морских свинок с приобретенной дентальной болезнью могут в различной степени проявляться гипорексия/анорексия, отказ от поедания грубых кормов (сено), гиперсаливация, снижение активности, выделения из глаз и носа. Животные с одонтогенными ретромассетерными абсцессами в каудальной части нижней челюсти обычно имеют округлую припухлость, которую трудно заметить у представителей пород с длинной шерстью1.Диагностика
После сбора анамнеза проводится физикальный осмотр с пальпацией области головы и оценкой возможности латеральных и каудоростральных движений нижней челюсти. Осмотр ротовой полости осуществляется под общей анестезией. Максимальное количество информации можно получить при проведении видеостоматоскопии – эндоскопии ротовой полости6.Оптимальным современным вариантом диагностики для морских свинок с предполагаемым ретромассетерным абсцессом будет комбинация видеостоматоскопии, КТ и МРТ.
Рентгенологическое исследование может быть недостаточно чувствительным в ряде случаев, однако при отсутствии возможности проведения КТ оно может являться обоснованной альтернативой (выполняются 5 экстраоральных проекций – правая латеральная, дорсовентральная, правая и левая косые, рострокаудальная, а также изолированные проекции нижней челюсти по Бомер 15). При проведении КТ оцениваются состояние зубов и костей верхней/нижней челюсти, распространенность остеомиелита, а при проведении МРТ – мягкотканные структуры, расположение абсцесса, состояние мышц и т. п.
Техника операции
Все действия хирурга можно разделить на два больших этапа: работа в ротовой полости и вне ротовой полости.Работа в ротовой полости. Животное в состоянии общей анестезии помещается в стоматологический столик для грызунов (стационарный роторасширитель) в стернальном положении, мягкие ткани щек раздвигают в стороны с помощью щекорасширителя (фото 7). Принципиально важно наличие хорошего источника света. Качество выполняемой работы значительно повышается при использовании бинокулярных луп.
После тщательного осмотра ротовой полости (визуально и с использованием стоматологических проб) проводятся интраоральная экстракция нежизнеспособных зубов, коррекция длины клинических коронок, работа с мягкотканными поражениями, удаление инородных тел и шерсти из периодонтальных карманов и т. п. в зависимости от того, что требует клиническая ситуация.
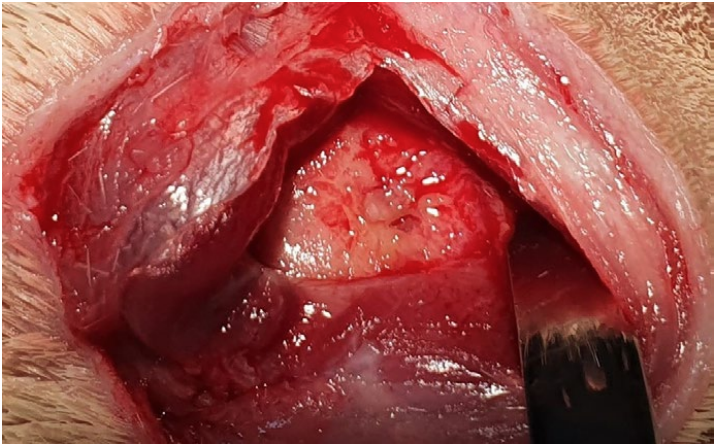
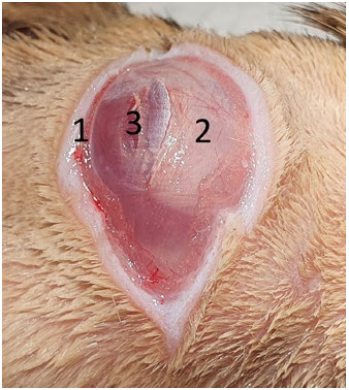
Работа вне ротовой полости. Животное размещается в латеральном положении, пораженная сторона находится сверху. После подготовки операционного поля проводится разрез кожи над абсцессом параллельно длинной оси нижней челюсти, тупым способом препарируются поверхностные мышцы (platysma). После этого визуализируется поверхностный слой массетера (часто бывает натянутым из-за давления абсцесса под ним) (фото 8). Далее проводятся диссекция каудальной части поверхностного слоя массетера в каудокраниальном направлении, ретракция поверхностного слоя и диссекция среднего слоя также в каудокраниальном направлении. Обычно на данном этапе визуализируется беловатая капсула абсцесса. Затем проводятся разрез капсулы, удаление гноя и максимально возможной площади поверхности капсулы, работа с пораженной остеомиелитом костью (удаление реминантов зубов, секвестров и т. п.). Гной и часть стенки капсулы отбираются для бактериологического исследования (аэробная и анаэробные культуры). Части массетера, вовлеченные в патологический процесс, должны быть резецированы15. После этого рана марсупиализируется (фото 9.2.). В большинстве случаев подобная техника не провоцирует развитие серьезных функциональных проблем1. Ушивание наглухо может приводить к рецидивам и некрозу массетера.
Послеоперационное лечение включает антибиотикотерапию, обезболивание, ассистированное кормление при сниженном аппетите. Местные обработки марсупиализированной раны проводят 1 раз с день с использованием 0,9%-ного раствора натрия хлорида.
Заключение
Синдром приобретенной дентальной болезни у морских свинок остается актуальной проблемой в практике ветеринарного врача – специалиста по лечению экзотических животных. Ретромассетерные абсцессы представляют особую сложность, однако при проведении полной диагностики и агрессивной техники хирургического вмешательства вероятность достижения устойчивой ремиссии повышается.Список литературы:
- Capello V., Lennox A. Advanced diagnostic imaging and surgical treatment of an odontogenic retromasseteric abscess in a guinea pig. J Small Anim Pract, 56(2): 134–7, Feb 2015. doi: 10.1111/jsap.12249.
- Capello V., Lennox A., Ghisleni G. Elodontoma in Two Guinea Pigs. J Vet Dent, Vol. 32, No 2, Summer 2015.
- Loic Legendre. Anatomy and Disorders of the Oral Cavity of Guinea Pigs. Vet Clin North Am Exot Anim Pract, 19(3): 825–42, Sep 2016. doi: 10.1016/j.cvex.2016.04.006.
- Anna Osofsky, Frank J. M. Verstraete. Dentistry in Pet Rodents. Compendium on Continuing Education for the Practicing Veterinarian, Vol 28, No 1, 2006.
- Hawkins M. G. Secondary nutritional hyperparathyroidism with fibrous osteodystrophy in 3 guinea pigs. Proceedings of 31st Annual AAV Conference and Expo. San Diego (CA), p. 121, 2010.
- Stephen J. Hernandez-Divers. Clinical Technique: Dental Endoscopy of Rabbits and Rodents. Journal of Exotic Pet Medicine, Volume 17, Issue 2, pp. 87–92, April 2008. Ссылка
- Philip G. Cox, Nathan Jeffery. Reviewing the Morphology of the Jaw-Closing Musculature in Squirrels, Rats, and Guinea Pigs with Contrast-Enhanced MicroCT. The Anatomical Record, 294: 915–928, 2011. Ссылка
- Schweda M. C., Hassan J., Böhler A., Tichy A., Reiter A. M., Künzel F. The role of computed tomography in the assessment of dental disease in 66 guinea pigs, Vet Rec, 175(21): 538, Nov 29, 2014. doi: 10.1136/vr.101469. Epub 2014 Jul 23.
- Rosemary Norman, Alison P. Wills. An Investigation into the Relationship between Owner Knowledge, Diet, and Dental Disease in Guinea Pigs (Cavia porcellus). Animals (Basel), 6(11): 73, Nov 14, 2016. doi: 10.3390/ani6110073.
- Müller J., Clauss M., Codron D., Schulz E., Hummel J., Kircher P., Hatt J. M. Tooth length and incisal wear and growth in guinea pigs (Cavia porcellus) fed diets of different abrasiveness. J Anim Physiol Anim Nutr, 99: 591–604, 2015.
- Legendre L. F. J. What antibiotics-impregnated materials are available for treating abscesses. Proceedings of NAVC, 2013.
- Marcy J. Souza, Cheryl B. Greenacre, James S. Avenell, Jonathan S. Wall, Gregory B. Daniel. Diagnosing a Tooth Root Abscess in a Guinea Pig (Cavia porcellus) Using Micro Computed Tomography Imaging. Journal of Exotic Pet Medicine, volume 15, Issue 4, pp. 274–277, October 2006.
- Crossley D. A. Clinical Aspects of Rodent Dental Anatomy. Journal of Veterinary Dentistry, 12(4): 131–135. doi:10.1177/089875649501200403
- Katherine Quesenberry, Christoph Mans, Connie Orcutt. Ferrets, Rabbits, and Rodents, Clinical Medicine and Surgery, 4th Edition. Saunders, pp. 527–535, 2020.
- Estella Böhmer. Dentistry in Rabbits and Rodents 1st Edition. John Wiley & Sons Limited, 2015.


 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург