1 Клиника для животных-компаньонов (отделение медицины), Школа ветеринарной медицины, Факультет наук о здоровье, Университет им. Аристотеля в Салониках, 54627 Салоники, Греция.
2 Лаборатория визуальной диагностики, Школа ветеринарной медицины, Факультет наук о здоровье, Университет им. Аристотеля в Салониках, 54627 Салоники, Греция.
3 Клиника для животных-компаньонов (отделение хирургии и акушерства), Школа ветеринарной медицины, Факультет наук о здоровье, Университет им. Аристотеля в Салониках, 54627 Салоники, Греция.
Автор, отвечающий за переписку: alexkon@vet.auth.gr
Окончание. Начало в №3.2023
Цель статьи: обзор определения, классификации, патогенеза, клинических проявлений и диагностики ВПСШ у собак и кошек в контексте клинического опыта авторов.
Гистопатология
Гистопатологические изменения, наблюдаемые в печени у пациентов с ВПСШ, отражают гипоперфузию воротной вены. Часто можно увидеть отсутствие или гипоплазию воротной вены, пролиферацию или дупликацию артериол, гепатоцеллюлярную (лобулярную) атрофию, пролиферацию желчных протоков, липидоз и липогранулемы47,120-124. Помимо этого, можно обнаружить гипертрофию гладкомышечных клеток, увеличение лимфатических сосудов вокруг центральных вен, гипертрофию клеток Ито и Купфера, гемосидероз, печеночный фиброз или некроз и воспаление23,57,120-123. Тяжесть гистопатологических изменений, судя по всему, коррелирует с объемом шунтируемой крови и может различаться между долями печени в зависимости от локализации шунта47. Пациенты с фиброзом, билиарной гиперплазией и некрозом имели неблагоприятный прогноз3,123. В других исследованиях гистологические поражения у собак с ВПСШ (как с внепеченочными, так и с внутрипеченочными) не коррелировали со временем выживания и прогнозом121,125.После хирургического лигирования шунтов гистопатологические поражения не разрешаются120,124.
Визуальная диагностика
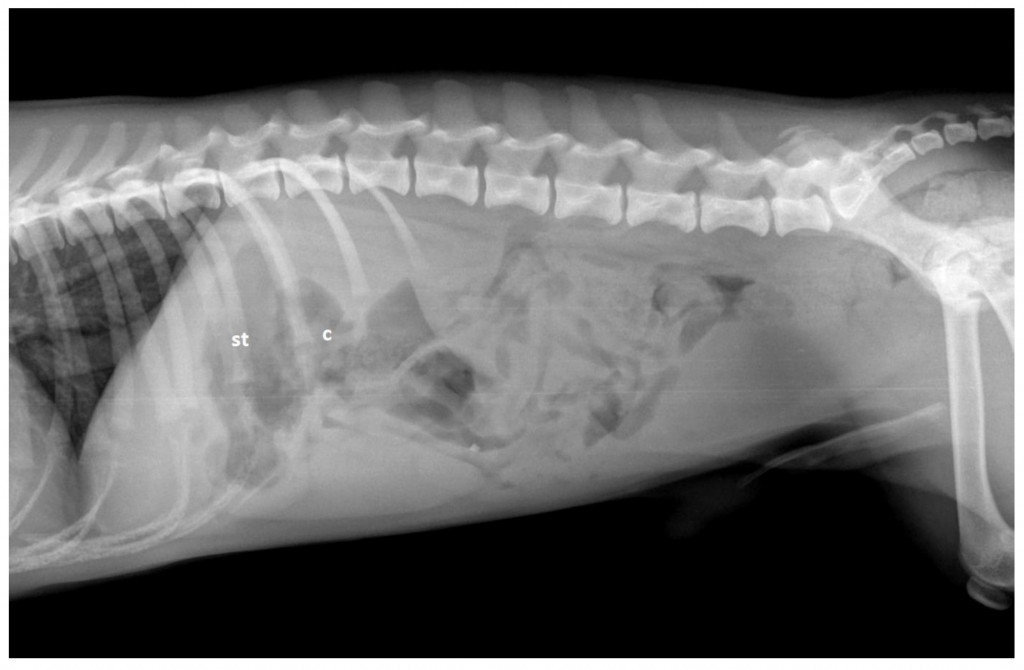
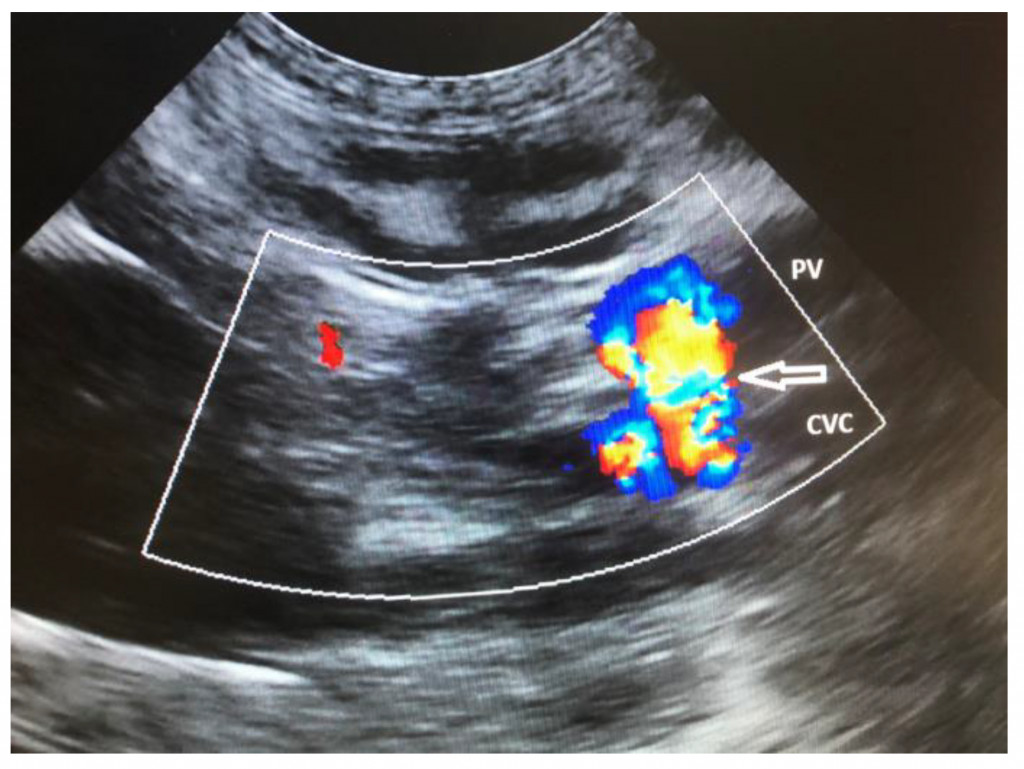
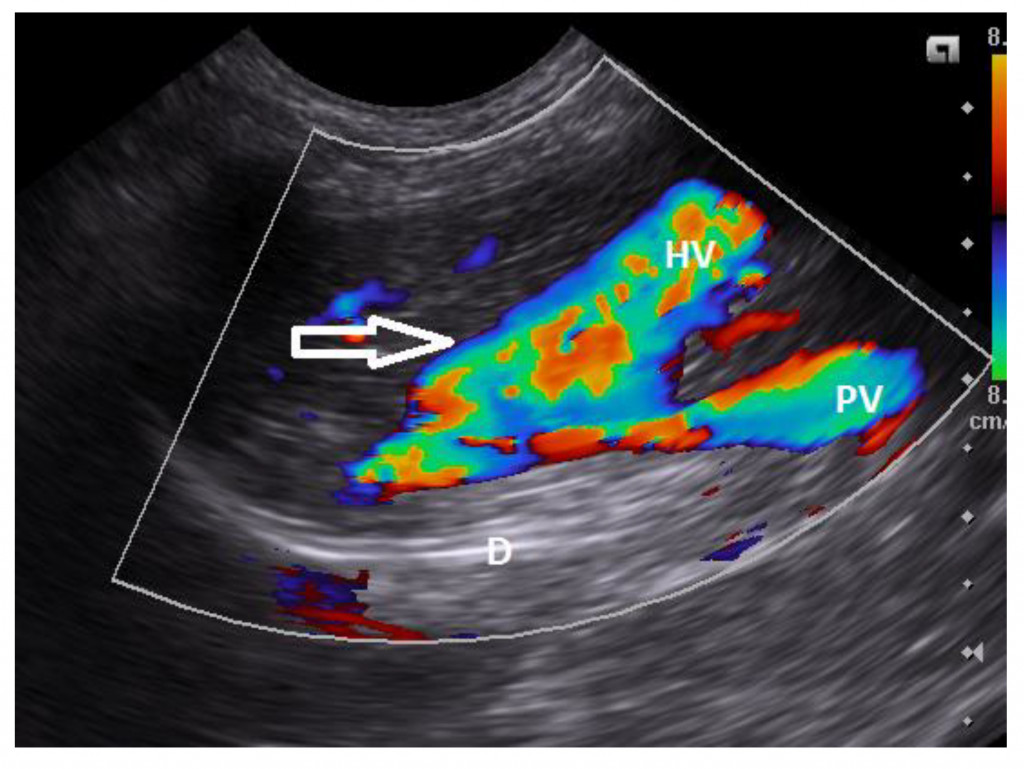
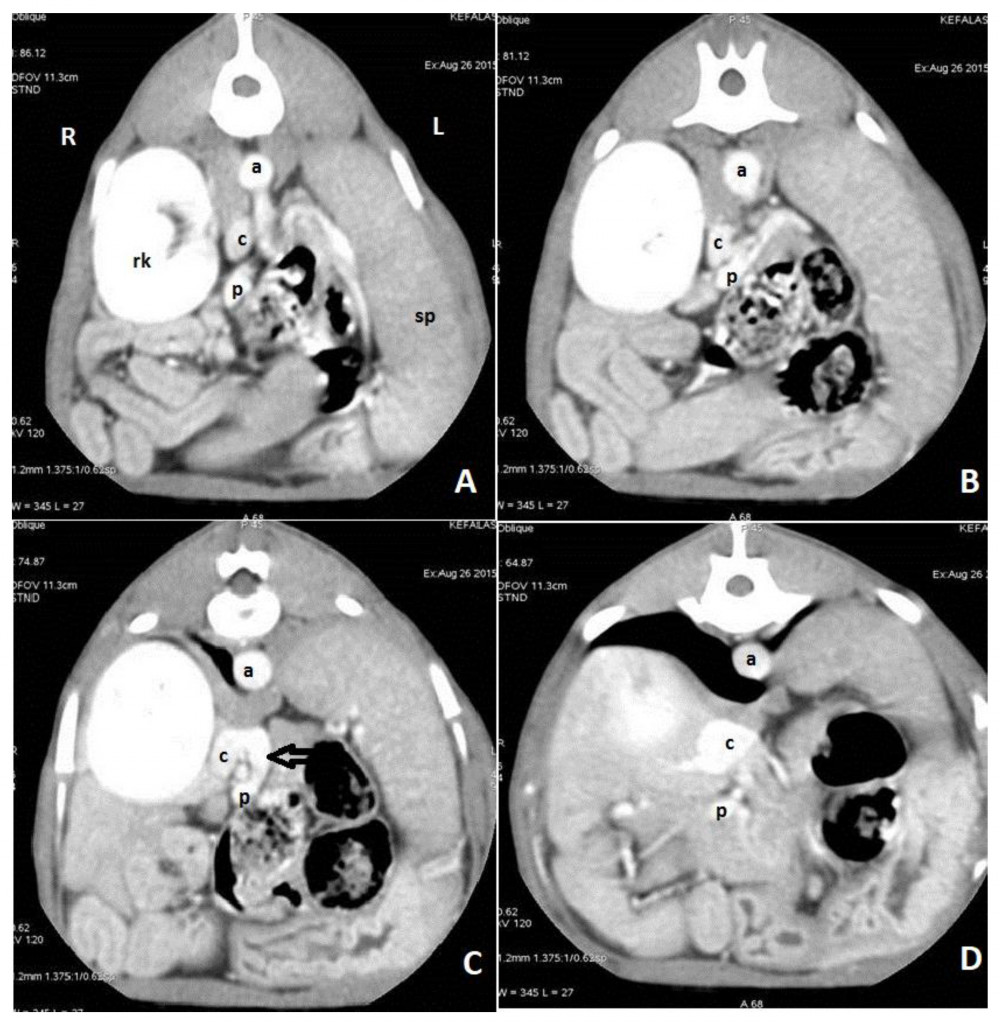
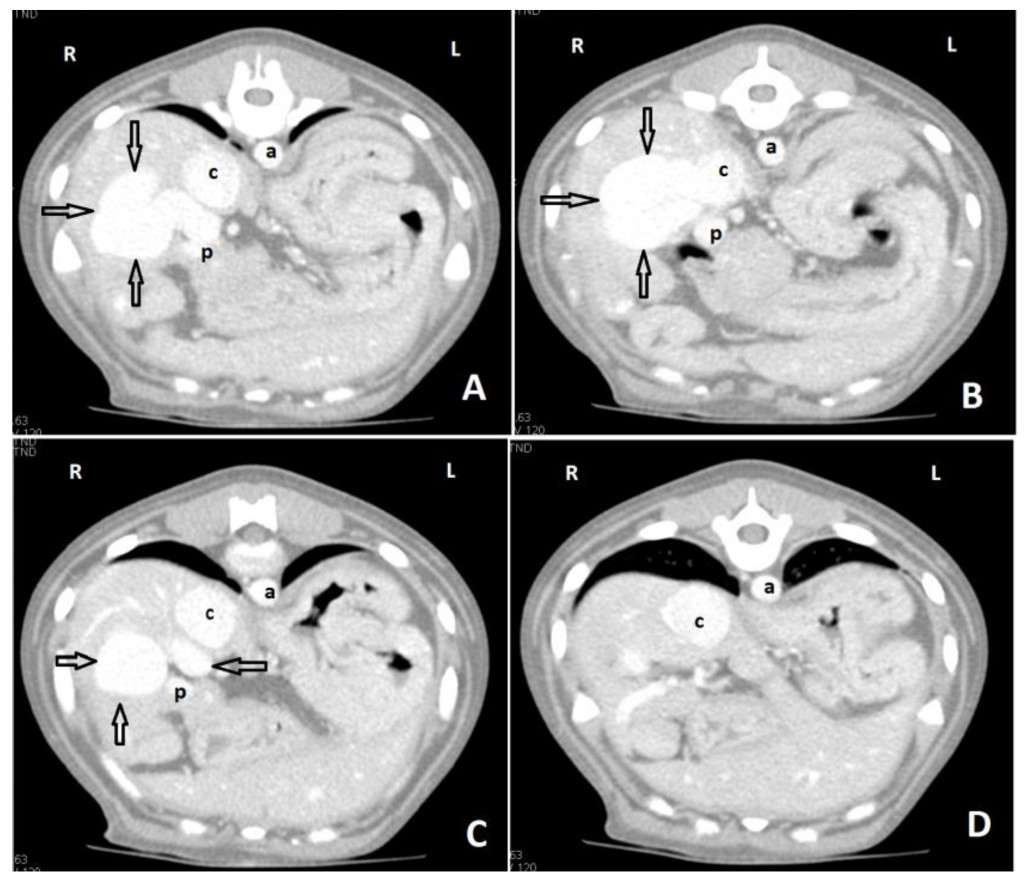
Ценность рентгенографии для диагностики заболеваний сосудов печени у собак очень ограничена. На ВПСШ могут указывать микрогепатия и билатеральная реномегалия (рис. 3)126. Уролиты из биурата аммония обычно рентгенопрозрачные, за исключением тех случаев, когда они содержат отложения солей кальция или струвиты.Для выявления ВПСШ у собак и кошек чаще всего используют ультрасонографию (УС), поскольку этот метод доступен повсеместно56,76,126-128. УС – это быстрое и неинвазивное исследование, которое можно выполнить без общей анестезии. Однако точность этого метода зависит от навыков оператора. Распространенными находками являются микрогепатия, плохая визуализация печеночных вен и ветвей воротной вены, присутствие аномального сосуда или увеличенные почки, а у собак с внепеченочными ВПСШ также снижается соотношение диаметров воротной вены и аорты30,56,60,76,128. Кроме того, в месте впадения ВПСШ в большой круг кровообращения можно обнаружить турбулентность потока крови. Для того чтобы поставить диагноз ВПСШ, необходимо визуализировать аномальный сосуд от его начала и до конца36,129. Szatmári et al.(2004) предложили протокол систематической ультрасонографической оценки системы воротной вены у собак129. Недостаток УС заключается в том, что точность обнаружения ВПСШ непостоянная (чувствительность составляет 74–95%, специфичность – 67–100%), поэтому неспособность увидеть ВПСШ на УС-изображениях не исключает его наличия56,127,128,130. УС позволяет обнаружить внутрипеченочный ВПСШ, а также описать его морфологию и расположение относительно долей печени (рис. 4, 5). Чувствительность и специфичность УС-идентификации внутрипеченочных ВПСШ могут достигать 100%, а поскольку они располагаются в паренхиме печени, их локализация более предсказуема, и они с большей вероятностью будут обнаружены с помощью УС, чем внепеченочные ВПСШ76,128,130.
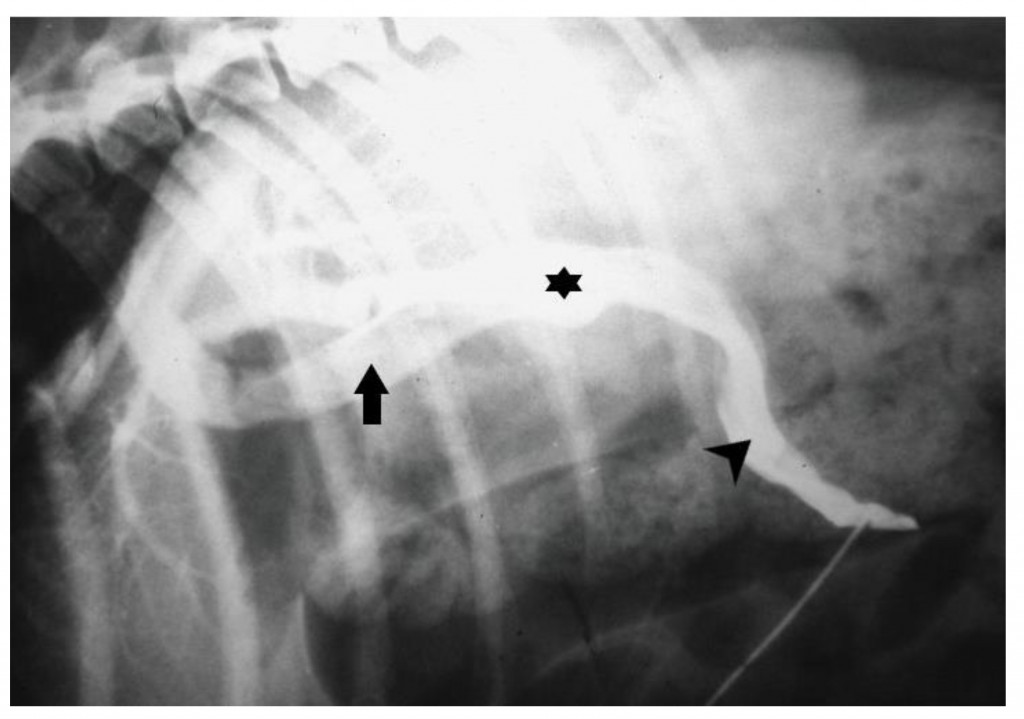
Еще одним методом визуальной диагностики, подходящим для выявления ВПСШ, является мезентериальная портовенография, но она используется редко, поскольку есть менее инвазивные методы – УС и КТА.
Для выполнения мезентериальной портовенографии проводят общую анестезию, затем срединную лапаротомию и катетеризируют тощекишечную вену. Далее в тощекишечную вену болюсно вводят водорастворимое стерильное рентгеноконтрастное вещество (2–4 мл/кг)131. После введения контраста проводят рентгеноскопию или рентгенографию. Чувствительность мезентериальной портовенографии для выявления ВПСШ колеблется в диапазоне 85–100% (рис. 6). Этот же тощекишечный катетер можно использовать для измерения давления в воротной вене во время операции. Однако из-за необходимости использования мобильных радиографических установок, инвазивности, переменных результатов и неспособности обеспечить предоперационное планирование этот метод был исключен из протоколов диагностики ВПСШ.
КТА – это неинвазивный, быстрый, точный и доступный по цене метод визуальной диагностики, который не только дает подробную информацию о морфологии шунта и сосудистой сети печени, но и позволяет спланировать хирургическое лечение15,20,22,132-135.
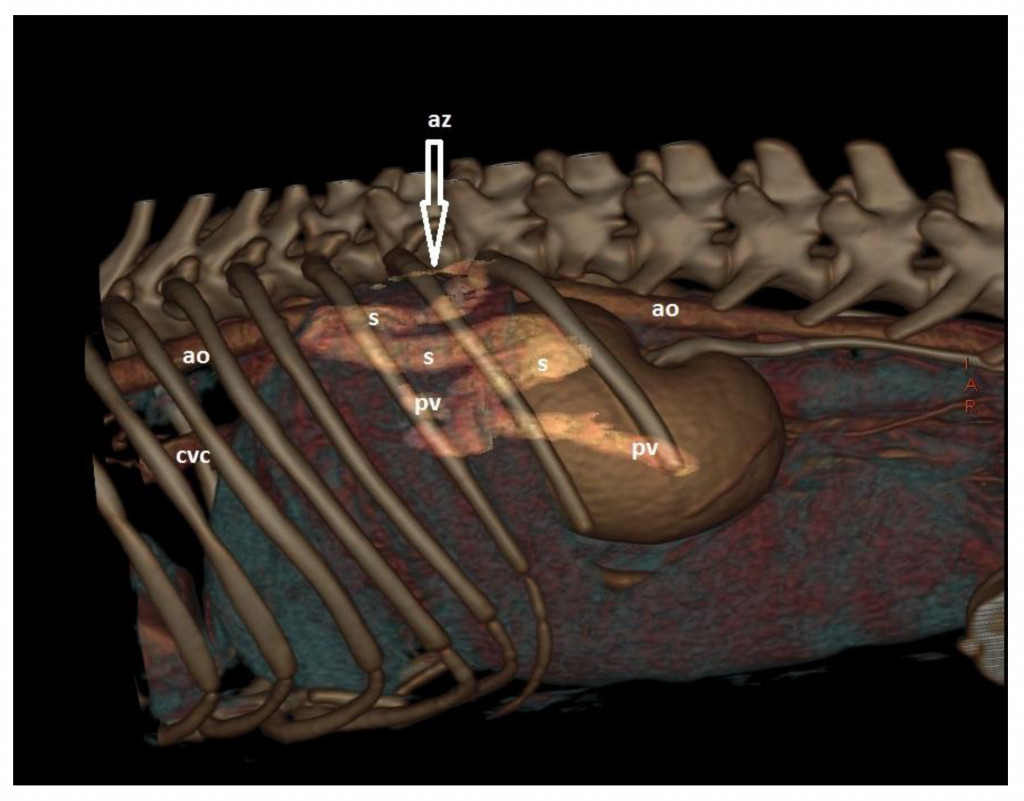
На сегодняшний день КТА является методом выбора для диагностики ВПСШ у собак и кошек (рис. 7, 8), поскольку она выявляет эту патологию с высокой чувствительностью и специфичностью135. В одном из исследований (Kim et al., 2013) чувствительность и специфичность КТА для выявления ПСШ составили 96 и 89% соответственно, что значительно превосходило абдоминальную ультрасонографию (68 и 84% соответственно), и вероятность выявить шунт с помощью КТА была в 5,5 раз выше, чем с помощью абдоминальной ультрасонографии132. После завершения исследования КТА-изображения можно обработать и реконструировать (то есть получить трехмерные изображения) с помощью соответствующего программного обеспечения (рис. 9).
Авторы настоящей статьи при доступности КТА рекомендуют всегда проводить ее с целью постановки окончательного диагноза, особенно в тех случаях, когда есть серьезные подозрения на ВПСШ, но его не получается локализовать с помощью УС или когда подозревается сложный или множественный ВПСШ.
Магнитно-резонансная ангиография (МРА) дает превосходные трехмерные изображения ВПСШ и является ценным инструментом предоперационного планирования. МРА для выявления ВПСШ использовалась в нескольких исследованиях136-138. В частности, группа исследователей (Seguin et al., 1999) выяснила, что чувствительность и специфичность МРА для диагностики ПСШ составили 80 и 100% соответственно, что было сравнимо с чувствительностью и специфичностью КТА, и у подавляющего большинства собак (83%) МРА позволяла дифференцировать внепеченочные и внутрипеченочные ВПСШ137. Однако КТА проще в выполнении, быстрее и дешевле, чем МРА.
Дифференциальные диагнозы
Зачастую индивидуальные особенности пациента, клинические признаки, результаты физикального обследования и лабораторные находки дают веские основания предполагать наличие ВПСШ. Тем не менее, работая с любой собакой или кошкой, у которой подозревают ВПСШ, важно помнить, что похожими симптомами могут проявляться и другие заболевания, в частности желудочно-кишечное паразитарное заболевание, ювенильная гипогликемия у представителей той-пород, идиопатическая эпилепсия, гидроцефалия, гипоадренокортицизм, энтеропатия с потерей белка и недостаточность ферментов цикла мочевины. У пациентов с повышенными сывороточной концентрацией ЖК и плазменной концентрацией АН необходимо дифференцировать ВПСШ и первичную гипоплазию воротной вены с наличием (например, нецирротическая портальная гипертензия) или отсутствием (микроваскулярная дисплазия [МВД]) портальной гипертензии (ПГВВ без ПГ), а также ВПСШ и печеночные артериовенозные мальформации. Похожие клинические признаки могут иметь собаки с другими заболеваниями печени, такими как хронический гепатит, цирроз или даже острое лептоспироз-ассоциированное заболевание печени, но такие пациенты обычно старше и имеют гипербилирубинемию.ПГВВ без ПГ заслуживает отдельного упоминания, поскольку по индивидуальным особенностям (порода, возраст и т. д.) такие собаки очень похожи на собак с внепеченочными ВПСШ, и эти патологии имеют много общих клинико-патологических характеристик. ПГВВ (МВД) тоже является врожденным заболеванием и, вероятно, наследуется сцепленно с сосудистой мальформацией, ассоциированной с микроскопической аномалией кровообращения в системе воротной вены47,104,139,140. ПГВВ без ПГ характеризуется недоразвитием внутрипеченочных терминальных ветвей воротной вены, из-за чего кровь не доходит до гепатоцитов. Точнее говоря, из-за гипоплазии терминальных внутрипеченочных портальных венул усиливается артериальный кровоток, чтобы сохранить нормальный кровоток в печеночных синусоидах, вследствие чего печеночные артерии в портальных триадах становятся гиперплазированными и извитыми. Эти изменения могут привести к синусоидальной гипертензии, открытию эмбриональных синусоидальных сосудов и транспортировке крови в центральные вены, что впоследствии приведет к нарушению перфузии печеночной паренхимы, снижению поступления в печень трофических факторов и, как следствие, – к атрофии печени.
ВПСШ и ПГВВ без ПГ – это генетически родственные заболевания, и ПГВВ без ПГ может как сопровождаться, так и не сопровождаться ВПСШ.
ПГВВ (МВД) впервые была описана у керн-терьеров140. В группу повышенного риска развития ПГВВ (МВД) входят многие собаки мелких пород, в частности керн-терьеры, йоркширские терьеры, мальтийские болонки, тибетские спаниели, цвергшнауцеры, ши-тцу, а также миниатюрные пудели и той-пудели139. Половой предрасположенности нет, хотя в одном ретроспективном исследовании (Christiansen et al., 2000) суки с ПГВВ (МВД) встречались чаще, чем кобели (70% случаев)139. Собаки с ПГВВ (МВД) поступают на прием в более позднем возрасте, чем собаки с ВПСШ, что, вероятно, обусловлено недостаточной выраженностью клинических признаков (случайное обнаружение повышенной сывороточной концентрации желчных кислот) или их отсутствием139.
Собак с ПГВВ (МВД) можно разделить на две группы: с наличием симптомов и бессимптомные. У большинства собак с ПГВВ без ПГ заболевание протекает бессимптомно, и обычно у таких пациентов нет клинических признаков, характерных для ВПСШ. У некоторых из них может быть непереносимость лекарственных веществ, метаболизируемых или экскретируемых печенью, что часто выявляется во время кастрации. Тем не менее собаки с ПГВВ могут поступать на прием с нарушениями со стороны ЦНС, ЖКТ и мочевыводящих путей104,139.
По опыту авторов, у подавляющего большинства собак с ПГВВ без ПГ заболевание протекает бессимптомно. Не исключено, что некоторые собаки с ПГВВ без ПГ, у которых проявляются симптомы, представляют собой случаи ВПСШ, когда шунт не удалось диагностировать или когда тяжесть клинических признаков отражает количество пораженных долей печени.
Выводы
Индивидуальные особенности пациента, результаты физикального обследования и лабораторные находки могут натолкнуть на подозрения о наличии ВПСШ. Однако клинические проявления ВПСШ неспецифичны, и их интенсивность может то нарастать, то ослабевать.Диагностика базируется на сочетании функциональных печеночных тестов (сывороточная концентрация ЖК и/или концентрация NH3) и визуального исследования печени (УС и/или КТА).
Для визуальной диагностики ВПСШ методом выбора является КТА, поскольку по ее результатам можно спланировать хирургическое лечение.
Вклад авторов. Написание и подготовка первоначального проекта – А.О.К.; написание, рецензирование и редактирование – К.К.А.-М., М.Н.П. и Л.Г.П. Все авторы прочитали опубликованную версию рукописи и согласились с ней.
Финансирование. Настоящее исследование не получало внешнего финансирования.
Конфликт интересов. Авторы заявляют об отсутствии каких-либо конфликтов интересов.
Ссылка на первоисточник (Vet Sci, 10, 160, 2023): Ссылка
Литература:
- Tobias, K. Portosystemic Shunts and Other Hepatic Vascular Anomalies. In Textbook of Small Animal Surgery; Slatter, D., Ed.; Saunders Elsevier: Philadelphia, PA, USA, 2003; pp. 727–751.
- Berent, A.; Tobias, K. Hepatic Vascular Anomalies. In Veterinary Surgery: Small Animal; Johnston, S., Tobias, K., Eds.; Elsevier: St. Louis, MO, USA, 2018; pp. 1852–1885.
- Weisse, C.; Berent, A. Hepatic Vascular Anomalies. In Textbook of Veterinary Internal Medicine; Ettinger, S., Feldman, E., Cote, E., Eds.; Saunders: St Louis, MO, USA, 2017; pp. 1639–1658.
- Markowitz, J.; Rappaport, A.; Scott, A.C. The Function of the Hepatic Artery in the Dog. Am. J. Dig. Dis. 1949, 16, 344–348.
- Evans, H.E.; de Lahunta, A. The Digestive Apparatus and Abdomen. In Miller’s Anatomy of the Dog; Evans, H.E., de Lahunta, A., Eds.; WB Saunders: St. Louis, MO, USA, 2013; pp. 281–338.
- Washabau, R.J. Liver. In Canine and Feline Gastroenterology; Washabau, R.J., Day, M.J., Eds.; Elsevier: St. Louis, MO, USA, 2013; pp. 849–957.
- Hickman, J.; Edwards, J.E.; Mann, F. Venous Anomalies in a Dog; Absence of the Portal Vein; Continuity of Lower Part of Inferior Vena Cava with the Azygos Vein. Anat. Rec. 1949, 104, 137–146.
- Audell, L.; Jönsson, L.; Lannek, B. Congenital Porta-Caval Shunts in the Dog; a Description of Three Cases. Zentralbl. Veterinarmed. A 1974, 21, 797–805.
- Ewing, G.; Suter, P.; Bailey, C. Hepatic Insufficiency Associated with Congenital Anomalies of the Portal Vein in Dogs. J. Am. Anim. Hosp. Assoc. 1974, 10, 463–476.
- White, R.N.; Parry, A.T. Morphology of Splenocaval Congenital Portosystemic Shunts in Dogs and Cats. J. Small Anim. Pract. 2016, 57, 28–32.
- White, R.N.; Parry, A.T. Morphology of Congenital Portosystemic Shunts Involving the Right Gastric Vein in Dogs. J. Small Anim. Pract. 2015, 56, 430–440.
- White, R.N.; Parry, A.T. Morphology of Congenital Portosystemic Shunts Involving the Left Colic Vein in Dogs and Cats. J. Small Anim. Pract. 2016, 57, 247–254.
- White, R.N.; Parry, A.T. Morphology of Congenital Portosystemic Shunts Emanating from the Left Gastric Vein in Dogs and Cats. J. Small Anim. Pract. 2013, 54, 459–467.
- White, R.N.; Parry, A.T.; Shales, C. Implications of Shunt Morphology for the Surgical Management of Extrahepatic Portosystemic Shunts. Aust. Vet. J. 2018, 96, 433–441.
- Fukushima, K.; Kanemoto, H.; Ohno, K.; Takahashi, M.; Fujiwara, R.; Nishimura, R.; Tsujimoto, H. Computed Tomographic Morphology and Clinical Features of Extrahepatic Portosystemic Shunts in 172 Dogs in Japan. Vet. J. 2014, 199, 376–381.
- White, R.N.; Shales, C.; Parry, A.T. New Perspectives on the Development of Extrahepatic Portosystemic Shunts. J. Small Anim. Pract. 2017, 58, 669–677.
- Seller, S.; Weisse, C.; Fischetti, A.J. Intrahepatic Venous Collaterals in Dogs with Congenital Intrahepatic Portosystemic Shunts Are Associated with Focal Shunt or Hepatic Vein Narrowing. Vet. Radiol. Ultrasound 2022, 63, 64–72.
- Bertolini, G. Anomalies of the Portal Venous System in Dogs and Cats as Seen on Multidetector-Row Computed Tomography: An Overview and Systematization Proposal. Vet. Sci. 2019, 6, 10.
- Plested, M.J.; Zwingenberger, A.L.; Brockman, D.J.; Hecht, S.; Secrest, S.; Culp, W.T.N.; Drees, R. Canine Intrahepatic Portosystemic Shunt Insertion into the Systemic Circulation Is Commonly through Primary Hepatic Veins as Assessed with CT Angiography. Vet. Radiol. Ultrasound 2020, 61, 519–530.
- Frank, P.; Mahaffey, M.; Egger, C.; Cornell, K.K. Helical Computed Tomographic Portography in Ten Normal Dogs and Ten Dogs with a Portosystemic Shunt. Vet. Radiol. Ultrasound 2003, 44, 392–400.
- Bertolini, G.; Diana, A.; Cipone, M.; Drigo, M.; Caldin, M. Multidetector Row Computed Tomography and Ultrasound Characteristics of Caudal Vena Cava Duplication in Dogs. Vet. Radiol. Ultrasound 2014, 55, 521–530.
- Zwingenberger, A.L.; Schwarz, T.; Saunders, H.M. Helical Computed Tomographic Angiography of Canine Portosystemic Shunts. Vet. Radiol. Ultrasound 2005, 46, 27–32.
- White, R.N.; Burton, C.A.; McEvoy, F.J. Surgical Treatment of Intrahepatic Portosystemic Shunts in 45 Dogs. Vet. Rec. 1998, 142, 358–365.
- Lamb, C.R.; White, R.N. Morphology of Congenital Intrahepatic Portacaval Shunts in Dogs and Cats. Vet. Rec. 1998, 142, 55–60.
- Parry, A.T.; White, R.N. Comparison of Computed Tomographic Angiography and Intraoperative Mesenteric Portovenography for Extrahepatic Portosystemic Shunts. J. Small Anim. Pract. 2017, 58, 49–55.
- White, R.N.; Burton, C.A. Anatomy of the Patent Ductus Venosus in the Dog. Vet. Rec. 2000, 146, 425–429.
- Payne, J.T.; Martin, R.A.; Constantinescu, G.M. The Anatomy and Embryology of Portosystemic Shunts in Dogs and Cats. Semin. Vet. Med. Surg. Small Anim. 1990, 5, 76–82.
- Lamb, C.R.; Burton, C.A. Doppler Ultrasonographic Assessment of Closure of the Ductus Venosus in Neonatal Irish Wolfhounds. Vet. Rec. 2004, 155, 699–701.
- Strickland, R.; Tivers, M.S.; Adamantos, S.E.; Harcourt-Brown, T.R.; Fowkes, R.C.; Lipscomb, V.J. Incidence and Risk Factors for Neurological Signs after Attenuation of Single Congenital Portosystemic Shunts in 253 Dogs. Vet. Surg. 2018, 47, 745–755.
- White, R.N.; Forster-van Hijfte, M.A.; Petrie, G.; Lamb, C.R.; Hammond, R.A. Surgical Treatment of Intrahepatic Portosystemic Shunts in Six Cats. Vet. Rec. 1996, 139, 314–317.
- Tivers, M.; Lipscomb, V. Congenital Portosystemic Shunts in Cats: Investigation, Diagnosis and Stabilisation. J. Feline Med. Surg. 2011, 13, 173–184.
- Leeman, J.J.; Kim, S.E.; Reese, D.J.; Risselada, M.; Ellison, G.W. Multiple Congenital PSS in a Dog: Case Report and Literature Review. J. Am. Anim. Hosp. Assoc. 2013, 49, 281–285.
- Gow, A.G. Hepatic Encephalopathy. Vet. Clin. N. Am. Small Anim. Pract. 2017, 47, 585–599.
- Lidbury, J.A.; Cook, A.K.; Steiner, J.M. Hepatic Encephalopathy in Dogs and Cats. J. Vet. Emerg. Crit. Care 2016, 26, 471–487.
- Ferenci, P.; Lockwood, A.; Mullen, K.; Tarter, R.; Weissenborn, K.; Blei, A.T. Hepatic Encephalopathy—Definition, Nomenclature, Diagnosis, and Quantification: Final Report of the Working Party at the 11th World Congresses of Gastroenterology, Vienna, 1998. Hepatology 2002, 35, 716–721.
- Szatmári, V.; Rothuizen, J.; van den Ingh, T.S.G.M.; van Sluijs, F.J.; Voorhout, G. Ultrasonographic Findings in Dogs with Hyperammonemia: 90 Cases (2000–2002). J. Am. Vet. Med. Assoc. 2004, 224, 717–727.
- Proot, S.; Biourge, V.; Teske, E.; Rothuizen, J. Soy Protein Isolate versus Meat-Based Low-Protein Diet for Dogs with Congenital Portosystemic Shunts. J. Vet. Intern. Med. 2009, 23, 794–800.
- Jalan, R.; Shawcross, D.; Davies, N. The Molecular Pathogenesis of Hepatic Encephalopathy. Int. J. Biochem. Cell Biol. 2003, 35, 1175–1181.
- Keiding, S.; Sørensen, M.; Bender, D.; Munk, O.L.; Ott, P.; Vilstrup, H. Brain Metabolism of 13N-Ammonia during Acute Hepatic Encephalopathy in Cirrhosis Measured by Positron Emission Tomography. Hepatology 2006, 43, 42–50.
- Bhatia, V.; Singh, R.; Acharya, S.K. Predictive Value of Arterial Ammonia for Complications and Outcome in Acute Liver Failure. Gut 2006, 55, 98–104.
- Rothuizen, J.; van den Ingh, T.S.G.A.M. Arterial and Venous Ammonia Concentrations in the Diagnosis of Canine Hepato-Encephalopathy. Res. Vet. Sci. 1982, 33, 17–21.
- Shawcross, D.; Jalan, R. The Pathophysiologic Basis of Hepatic Encephalopathy: Central Role for Ammonia and Inflammation. Cell. Mol. Life Sci. 2005, 62, 2295–2304.
- Coltart, I.; Tranah, T.H.; Shawcross, D.L. Inflammation and Hepatic Encephalopathy. Arch. Biochem. Biophys. 2013, 536, 189–196.
- Gow, A.G.; Marques, A.I.; Yool, D.A.; Crawford, K.; Warman, S.M.; Eckersall, P.D.; Jalan, R.; Mellanby, R.J. Dogs with Congenital Porto-Systemic Shunting (CPSS) and Hepatic Encephalopathy Have Higher Serum Concentrations of C-Reactive Protein than Asymptomatic Dogs with CPSS. Metab. Brain Dis. 2012, 27, 227–229.
- Tivers, M.S.; Handel, I.; Gow, A.G.; Lipscomb, V.J.; Jalan, R.; Mellanby, R.J. Hyperammonemia and Systemic Inflammatory Response Syndrome Predicts Presence of Hepatic Encephalopathy in Dogs with Congenital Portosystemic Shunts. PLoS ONE 2014, 9, e82303.
- Howe, L.M.; Boothe, D.M.; Boothe, H.W. Endotoxemia Associated with Experimentally Induced Multiple Portosystemic Shunts in Dogs. Am. J. Vet. Res. 1997, 58, 83–88.
- Cullen, J.; van den Ingh, T.; Bunch, S.; Rothuizen, J.; Washabau, R.; Desmet, V. Morphological Classification of Circulatory Disorders of the Canine and Feline Liver. In WSAVA Standards for Clinical and Histological Diagnosis of Canine and Feline Liver Diseases; WSAVA Liver Standardization Group, Ed.; Saunders Elsevier: St. Louis, MO, USA, 2006; pp. 41–60.
- Kelley, D.; Lester, C.; Delaforcade, A.; Webster, C.R.L. Thromboelastographic Evaluation of Dogs with Congenital Portosystemic Shunts. J. Vet. Intern. Med. 2013, 27, 1262–1267.
- Kummeling, A.; Teske, E.; Rothuizen, J.; van Sluijs, F.J. Coagulation Profiles in Dogs with Congenital Portosystemic Shunts before and after Surgical Attenuation. J. Vet. Intern. Med. 2006, 20, 1319–1326.
- Hunt, G.B.; Kummeling, A.; Tisdall, P.L.C.; Marchevsky, A.M.; Liptak, J.M.; Youmans, K.R.; Goldsmid, S.E.; Beck, J.A. Outcomes of Cellophane Banding for Congenital Portosystemic Shunts in 106 Dogs and 5 Cats. Vet. Surg. 2004, 33, 25–31.
- Mehl, M.L.; Kyles, A.E.; Hardie, E.M.; Kass, P.H.; Adin, C.; Flynn, A.K.; De Cock, H.E.; Gregory, C.R. Evaluation of Ameroid Ring Constrictors for Treatment for Single Extrahepatic Portosystemic Shunts in Dogs: 168 Cases (1995–2001). J. Am. Vet. Med. Assoc. 2005, 226, 2020–2030.
- Holford, A.L.; Tobias, K.M.; Bartges, J.W.; Johnson, B.M. Adrenal Response to Adrenocorticotropic Hormone in Dogs before and after Surgical Attenuation of a Single Congenital Portosystemic Shunt. J. Vet. Intern. Med. 2008, 22, 832–838.
- Tobias, K.M.; Rohrbach, B.W. Association of Breed with the Diagnosis of Congenital Portosystemic Shunts in Dogs: 2400 Cases (1980–2002). J. Am. Vet. Med. Assoc. 2003, 223, 1636–1639.
- Weisse, C.; Berent, A.C.; Todd, K.; Solomon, J.A.; Cope, C. Endovascular Evaluation and Treatment of Intrahepatic Portosystemic Shunts in Dogs: 100 Cases (2001–2011). J. Am. Vet. Med. Assoc. 2014, 244, 78–94.
- Bostwick, D.R.; Twedt, D.C. Intrahepatic and Extrahepatic Portal Venous Anomalies in Dogs: 52 Cases (1982–1992). J. Am. Vet. Med. Assoc. 1995, 206, 1181–1185.
- Lamb, C.R.; Forster-van Hijfte, M.A.; White, R.N.; McEvoy, F.J.; Rutgers, H.C. Ultrasonographic Diagnosis of Congenital Portosystemic Shunt in 14 Cats. J. Small Anim. Pract. 1996, 37, 205–209.
- Rothuizen, J.; van den Ingh, T.S.G.A.M.; Voorhoutm, G.; van dER Luer, R.J.T.; Wouda, W. Congenital Portosystemic Shunts in Sixteen Dogs and Three Cats. J. Small Anim. Pract. 1982, 23, 67–81.
- Hunt, G.B. Effect of Breed on Anatomy of Portosystemic Shunts Resulting from Congenital Diseases in Dogs and Cats: A Review of 242 Cases. Aust. Vet. J. 2004, 82, 746–749.
- Tillson, D.M.; Winkler, J.T. Diagnosis and Treatment of Portosystemic Shunts in the Cat. Vet. Clin. N. Am.-Small Anim. Pract. 2002, 32, 881–899.
- Blaxter, A.C.; Holt, P.E.; Pearson, G.R.; Gibbs, C.; Gruffydd-Jones, T.J. Congenital Portosystemic Shunts in the Cat: A Report of Nine Cases. J. Small Anim. Pract. 1988, 29, 631–645.
- van Steenbeek, F.G.; Leegwater, P.A.J.; van Sluijs, F.J.; Heuven, H.C.M.; Rothuizen, J. Evidence of Inheritance of Intrahepatic Portosystemic Shunts in Irish Wolfhounds. J. Vet. Intern. Med. 2009, 23, 950–952.
- Kerr, M.G.; Van Doorn, T. Mass Screening of Irish Wolfhound Puppies for Portosystemic Shunts by the Dynamic Bile Acid Test. Vet. Rec. 1999, 144, 693–696.
- Meyer, H.P.; Rothuizen, J.; Ubbink, G.J.; van den Ingh, T.S. Increasing Incidence of Hereditary Intrahepatic Portosystemic Shunts in Irish Wolfhounds in The Netherlands (1984 to 1992). Vet. Rec. 1995, 136, 13–16.
- Worley, D.R.; Holt, D.E. Clinical Outcome of Congenital Extrahepatic Portosystemic Shunt Attenuation in Dogs Aged Five Years and Older: 17 Cases (1992–2005). J. Am. Vet. Med. Assoc. 2008, 232, 722–727.
- Winkler, J.T.; Bohling, M.W.; Tillson, M.D.; Wright, J.C.; Ballagas, A.J. Portosystemic Shunts: Diagnosis, Prognosis, and Treatment of 64 Cases (1993–2001). J. Am. Anim. Hosp. Assoc. 2003, 39, 169–185.
- Boothe, H.W.; Howe, L.M.; Edwards, J.F.; Slater, M.R. Multiple Extrahepatic Portosystemic Shunts in Dogs: 30 Cases (1981–1993). J. Am. Vet. Med. Assoc. 1996, 208, 1849–1854.
- Fryer, K.J.; Levine, J.M.; Peycke, L.E.; Thompson, J.A.; Cohen, N.D. Incidence of Postoperative Seizures with and without Levetiracetam Pretreatment in Dogs Undergoing Portosystemic Shunt Attenuation. J. Vet. Intern. Med. 2011, 25, 1379–1384.
- van den Ingh, T.S.G.A.M.; Rothuizen, J.; Meyer, H.P. Circulatory Disorders of the Liver in Dogs and Cats. Vet. Q. 1995, 17, 70–76.
- Berent, A.C.; Tobias, K.M. Portosystemic Vascular Anomalies. Vet. Clin. N. Am. Small Anim. Pract. 2009, 39, 513–541.
- Havig, M.; Tobias, K.M. Outcome of Ameroid Constrictor Occlusion of Single Congenital Extrahepatic Portosystemic Shunts in Cats: 12 Cases (1993–2000). J. Am. Vet. Med. Assoc. 2002, 220, 337–341.
- Lipscomb, V.J.; Jones, H.J.; Brockman, D.J. Complications and Long-Term Outcomes of the Ligation of Congenital Portosystemic Shunts in 49 Cats. Vet. Rec. 2007, 160, 465–470.
- Caporali, E.H.G.; Phillips, H.; Underwood, L.; Selmic, L.E. Risk Factors for Urolithiasis in Dogs with Congenital Extrahepatic Portosystemic Shunts: 95 Cases (1999–2013). J. Am. Vet. Med. Assoc. 2015, 246, 530–536.
- Dear, J.D.; Shiraki, R.; Ruby, A.L.; Westropp, J.L. Feline Urate Urolithiasis: A Retrospective Study of 159 Cases. J. Feline Med. Surg. 2011, 13, 725–732.
- van Gundy, T.E.; Boothe, H.W.; Wolf, A. Results of Surgical Management of Feline Portosystemic Shunts. J. Am. Anim. Hosp. Assoc. 1990, 26, 55–62.
- Lipscomb, V.J.; Lee, K.C.; Lamb, C.R.; Brockman, D.J. Association of Mesenteric Portovenographic Findings with Outcome in Cats Receiving Surgical Treatment for Single Congenital Portosystemic Shunts. J. Am. Vet. Med. Assoc. 2009, 234, 221–228.
- Lamb, C. Ultrasonographic Diagnosis of Congenital Portosystemic Shunts on Dogs: Results of a Prospective Study. Vet. Radiol. Ultrasound 1996, 37, 281–288.
- Kyles, A.E.; Hardie, E.M.; Mehl, M.; Gregory, C.R. Evaluation of Ameroid Ring Constrictors for the Management of Single Extrahepatic Portosystemic Shunts in Cats: 23 Cases (1996–2001). J. Am. Vet. Med. Assoc. 2002, 220, 1341–1347.
- Deppe, T.A.; Center, S.A.; Simpson, K.W.; Erb, H.N.; Randolph, J.F.; Dykes, N.L.; Yeager, A.E.; Reynolds, A.J. Glomerular Filtration Rate and Renal Volume in Dogs with Congenital Portosystemic Vascular Anomalies before and after Surgical Ligation. J. Vet. Intern. Med. 1999, 13, 465–471.
- Scavelli, T.D.; Hornbuckle, W.E.; Roth, L.; Rendano, V.T.; de Lahunta, A.; Center, S.A.; French, T.W.; Zimmer, J.F. Portosystemic Shunts in Cats: Seven Cases (1976-1984). J. Am. Vet. Med. Assoc. 1986, 189, 317–325.
- Kraun, M.B.; Nelson, L.L.; Hauptman, J.G.; Nelson, N.C. Analysis of the Relationship of Extrahepatic Portosystemic Shunt Morphology with Clinical Variables in Dogs: 53 Cases (2009–2012). J. Am. Vet. Med. Assoc. 2014, 245, 540–549.
- Sura, P.A.; Tobias, K.M.; Morandi, F.; Daniel, G.B.; Echandi, R.L. Comparison of 99mTcO4(-) Trans-Splenic Portal Scintigraphy with per-Rectal Portal Scintigraphy for Diagnosis of Portosystemic Shunts in Dogs. Vet. Surg. 2007, 36, 654–660.
- Simpson, K.W.; Meyer, D.J.; Boswood, A.; White, R.N.; Maskell, I.E. Iron Status and Erythrocyte Volume in Dogs with Congenital Portosystemic Vascular Anomalies. J. Vet. Intern. Med. 1997, 11, 14–19.
- Bunch, S.E.; Jordan, H.L.; Sellon, R.K.; Cullen, J.M.; Smith, J.E. Characterization of Iron Status in Young Dogs with Portosystemic Shunt. Am. J. Vet. Res. 1995, 56, 853–858.
- Laflamme, D.P.; Mahaffey, E.A.; Allen, S.W.; Twedt, D.C.; Prasse, K.W.; Huber, T.L. Microcytosis and Iron Status in Dogs With Surgically Induced Portosystemic Shunts. J. Vet. Intern. Med. 1994, 8, 212–216.
- Frowde, P.E.; Gow, A.G.; Burton, C.A.; Powell, R.; Lipscomb, V.J.; House, A.K.; Mellanby, R.J.; Tivers, M.S. Hepatic Hepcidin Gene Expression in Dogs with a Congenital Portosystemic Shunt. J. Vet. Intern. Med. 2014, 28, 1203–1205.
- Watson, P.J.; Herrtage, M.E. Medical Management of Congenital Portosystemic Shunts in 27 Dogs-a Retrospective Study. J. Small Anim. Pract. 1998, 39, 62–68.
- Papazoglou, L.G.; Monnet, E.; Seim, H.B. Survival and Prognostic Indicators for Dogs with Intrahepatic Portosystemic Shunts: 32 Cases (1990–2000). Vet. Surg. 2002, 31, 561–570.
- Webster, C.R.L. Hemostatic Disorders Associated with Hepatobiliary Disease. Vet. Clin. N. Am. Small Anim. Pract. 2017, 47, 601–615.
- Toulza, O.; Center, S.; Brooks, M.B.; Erb, H.N.; Warner, K.L.; Deal, W. Evaluation of Plasma Protein C Activity for Detection of Hepatobiliary Disease and Portosystemic Shunting in Dogs. J. Am. Vet. Med. Assoc. 2006, 229, 1761–1771.
- Niles, J.D.; Williams, J.M.; Cripps, P.J. Hemostatic Profiles in 39 Dogs with Congenital Portosystemic Shunts. Vet. Surg. 2001, 30, 97–104.
- Prins, M.; Schellens, C.J.M.M.; van Leeuwen, M.W.; Rothuizen, J.; Teske, E. Coagulation Disorders in Dogs with Hepatic Disease. Vet. J. 2010, 185, 163–168.
- Roy, R.G.; Post, G.S.; Waters, D.J.; Hardy, R.M. Portal Vein Thrombosis as a Complication of Portosystemic Shunt Ligation in Two Dogs. J Am Anim. Hosp. Assoc. 1992, 28, 53–58.
- Tzounos, C.E.; Tivers, M.S.; Adamantos, S.E.; English, K.; Rees, A.L.; Lipscomb, V.J. Haematology and Coagulation Profiles in Cats with Congenital Portosystemic Shunts. J. Feline Med. Surg. 2017, 19, 1290–1296.
- Center, S.A.; Magne, M.L. Historical, Physical Examination, and Clinicopathologic Features of Portosystemic Vascular Anomalies in the Dog and Cat. Semin. Vet. Med. Surg. (Small Anim.) 1990, 5, 83–93.
- Broome, C.J.; Walsh, V.P.; Braddock, J. a Congenital Portosystemic Shunts in Dogs and Cats. N. Z. Vet. J. 2004, 52, 154–162.
- Johnson, C.A.; Armstrong, P.J.; Hauptman, J.G. Congenital Portosystemic Shunts in Dogs: 46 Cases (1979–1986). J. Am. Vet. Med. Assoc. 1987, 191, 1478–1483.
- Center, S.A.; ManWarren, T.; Slater, M.R.; Wilentz, E. Evaluation of Twelve-Hour Preprandial and Two-Hour Postprandial Serum Bile Acids Concentrations for Diagnosis of Hepatobiliary Disease in Dogs. J. Am. Vet. Med. Assoc. 1991, 199, 217–226.
- Center, S.A.; Erb, H.N.; Joseph, S.A. Measurement of Serum Bile Acids Concentrations for Diagnosis of Hepatobiliary Disease in Cats. J. Am. Vet. Med. Assoc. 1995, 207, 1048–1054.
- Center, S.A.; Baldwin, B.H.; Erb, H.; Tennant, B.C. Bile Acid Concentrations in the Diagnosis of Hepatobiliary Disease in the Cat. J. Am. Vet. Med. Assoc. 1986, 189, 891–896.
- Center, S.A.; Baldwin, B.H.; de Lahunta, A.; Dietze, A.E.; Tennant, B.C. Evaluation of Serum Bile Acid Concentrations for the Diagnosis of Portosystemic Venous Anomalies in the Dog and Cat. J. Am. Vet. Med. Assoc. 1985, 186, 1090–1094.
- Ruland, K.; Fischer, A.; Hartmann, K. Sensitivity and Specificity of Fasting Ammonia and Serum Bile Acids in the Diagnosis of Portosystemic Shunts in Dogs and Cats. Vet. Clin. Pathol. 2010, 39, 57–64.
- Jensen, A.L. Evaluation of Fasting and Postprandial Total Serum Bile Acid Concentration in Dogs with Hepatobiliary Disorders. Zentralbl. Veterinarmed. A 1991, 38, 247–254.
- Chapman, S.E.; Hostutler, R.A. A Laboratory Diagnostic Approach to Hepatobiliary Disease in Small Animals. Vet. Clin. N. Am. Small Anim. Pract. 2013, 43, 1209–1225.
- Allen, L.; Stobie, D.; Mauldin, G.N.; Baer, K.E. Clinicopathologic Features of Dogs with Hepatic Microvascular Dysplasia with and without Portosystemic Shunts: 42 Cases (1991–1996). J. Am. Vet. Med. Assoc. 1999, 214, 218–220.
- Tisdall, P.L.; Hunt, G.B.; Bellenger, C.R.; Malik, R. Congenital Portosystemic Shunts in Maltese and Australian Cattle Dogs. Aust. Vet. J. 1994, 71, 174–178.
- Deitz, K.L.; Makielski, K.M.; Williams, J.M.; Lin, H.; Morrison, J.A. Effect of 6-8 Weeks of Oral Ursodeoxycholic Acid Administration on Serum Concentrations of Fasting and Postprandial Bile Acids and Biochemical Analytes in Healthy Dogs. Vet. Clin. Pathol. 2015, 44, 431–436.
- Strombeck, D.R.; Meyer, D.J.; Freedland, R.A. Hyperammonemia Due to a Urea Cycle Enzyme Deficiency in Two Dogs. J. Am. Vet. Med. Assoc. 1975, 166, 1109–1111.
- Zandvliet, M.M.J.M.; Rothuizen, J. Transient Hyperammonemia Due to Urea Cycle Enzyme Deficiency in Irish Wolfhounds. J. Vet. Intern. Med. 2007, 21, 215–218.
- Walker, M.C.; Hill, R.C.; Guilford, W.G.; Scott, K.C.; Jones, G.L.; Buergelt, C.D. Postprandial Venous Ammonia Concentrations in the Diagnosis of Hepatobiliary Disease in Dogs. J. Vet. Intern. Med. 2001, 15, 463–466.
- Whiting, P.G.; Breznock, E.M.; Moore, P.; Kerr, L.; Berger, B.; Gregory, C.; Hornof, W. Partial Hepatectomy with Temporary Hepatic Vascular Occlusion in Dogs with Hepatic Arteriovenous Fistulas. Vet. Surg. 1986, 15, 171–180.
- van Straten, G.; Spee, B.; Rothuizen, J.; van Straten, M.; Favier, R.P. Diagnostic Value of the Rectal Ammonia Tolerance Test, Fasting Plasma Ammonia and Fasting Plasma Bile Acids for Canine Portosystemic Shunting. Vet. J. 2015, 204, 282–286.
- Rothuizen, J.; van den Ingh, T.S.G.A.M. Rectal Ammonia Tolerance Test in the Evaluation of Portal Circulation in Dogs with Liver Disease. Res. Vet. Sci. 1982, 33, 22–25.
- Meyer, H.P.; Rothuizen, J.; Tiemessen, I.; Van Den Brom, W.E.; Van Den Ingh, T.S.G.A.M. Transient Metabolic Hyperammonaemia in Young Irish Wolfhounds. Vet. Rec. 1996, 138, 105–107.
- Danese, S.; Vetrano, S.; Zhang, L.; Poplis, V.A.; Castellino, F.J. The Protein C Pathway in Tissue Inflammation and Injury: Pathogenic Role and Therapeutic Implications. Blood 2010, 115, 1121–1130.
- Aird, W.C. Natural Anticoagulant Inhibitors: Activated Protein C. Best Pract. Res. Clin. Haematol. 2004, 17, 161–182. Sunlight, C.; Weisse, C.; Berent, A.; Tozier, E. Protein C and Comparative Biochemical Changes in Dogs Treated with Percutaneous Transvenous Coil Embolization of Congenital Intrahepatic Portosystemic Shunts. Vet. Surg. 2022, 51, 125–135.
- Tarnow, I.; Falk, T.; Tidholm, A.; Martinussen, T.; Jensen, A.L.; Olsen, L.H.; Pedersen, H.D.; Kristensen, A.T. Hemostatic Biomarkers in Dogs with Chronic Congestive Heart Failure. J. Vet. Intern. Med. 2007, 21, 451–457.
- de Laforcade, A.M.; Rozanski, E.A.; Freeman, L.M.; Li, W. Serial Evaluation of Protein C and Antithrombin in Dogs with Sepsis. J. Vet. Intern. Med. 2008, 22, 26–30.
- de Laforcade, A.M.; Freeman, L.M.; Shaw, S.P.; Brooks, M.B.; Rozanski, E.A.; Rush, J.E. Hemostatic Changes in Dogs with Naturally Occurring Sepsis. J. Vet. Intern. Med. 2003, 17, 674–679.
- Lee, K.C.L.; Winstanley, A.; House, J.V.; Lipscomb, V.; Lamb, C.; Gregory, S.; Jalan, R.; Mookerjee, R.P.; Brockman, D.J. Association between Hepatic Histopathologic Lesions and Clinical Findings in Dogs Undergoing Surgical Attenuation of a Congenital Portosystemic Shunt: 38 Cases (2000–2004). J. Am. Vet. Med. Assoc. 2011, 239, 638–645.
- Parker, J.S.; Monnet, E.; Powers, B.E.; Twedt, D.C. Histologic Examination of Hepatic Biopsy Samples as a Prognostic Indicator in Dogs Undergoing Surgical Correction of Congenital Portosystemic Shunts: 64 Cases (1997–2005). J. Am. Vet. Med. Assoc. 2008, 232, 1511–1514.
- Isobe, K.; Matsunaga, S.; Nakayama, H.; Uetsuka, K. Histopathological Characteristics of Hepatic Lipogranulomas with Portosystemic Shunt in Dogs. J. Vet. Med. Sci. Jpn. Soc. Vet. Sci. 2008, 70, 133–138.
- Baade, S.; Aupperle, H.; Grevel, V.; Schoon, H.A. Histopathological and Immunohistochemical Investigations of Hepatic Lesions Associated with Congenital Portosystemic Shunt in Dogs. J. Comp. Pathol. 2006, 134, 80–90.
- Swinbourne, F.; Smith, K.C.; Lipscomb, V.J.; Tivers, M.S. Histopathological Findings in the Livers of Cats with a Congenital Portosystemic Shunt before and after Surgical Attenuation. Vet. Rec. 2013, 172, 362.
- Hunt, G.B.; Luff, J.; Daniel, L.; Zwingenberger, A. Does Hepatic Steatosis Have an Impact on the Short Term Hepatic Response after Complete Attenuation of Congenital Extrahepatic Portosystemic Shunts? A Prospective Study of 20 Dogs. Vet. Surg. 2014, 43, 920–925.
- Lamb, C.R. Ultrasonography of Portosystemic Shunts in Dogs and Cats. Vet. Clin. N. Am. Small Anim. Pract. 1998, 28, 725–753.
- Tiemessen, I.; Rothuizen, J.; Voorhout, G. Ultrasonography in the Diagnosis of Congenital Portosystemic Shunts in Dogs. Vet. Q. 1995, 17, 50–53.
- D’Anjou, M.A.; Penninck, D.; Cornejo, L.; Pibarot, P. Ultrasonographic Diagnosis of Portosystemic Shunting in Dogs and Cats. Vet. Radiol. Ultrasound 2004, 45, 424–437.
- Szatmári, V.; Rothuizen, J.; Voorhout, G. Standard Planes for Ultrasonographic Examination of the Portal System in Dogs. J. Am. Vet. Med. Assoc. 2004, 224, 713–716, 698–699.
- Holt, D.E.; Schelling, C.G.; Saunders, H.M.; Orsher, R.J. Correlation of Ultrasonographic Findings with Surgical, Portographic, and Necropsy Findings in Dogs and Cats with Portosystemic Shunts: 63 Cases (1987–1993). J. Am. Vet. Med. Assoc. 1995, 207, 1190–1193.
- Berent, A.; Weisse, C. Hepatic Vascular Anomalies. In Textbook of Veterinary Internal Medicine; Ettinge, S., Feldman, E., Eds.; Elsevier: St. Louis, MO, USA, 2010; pp. 1649–1671.
- Kim, S.E.; Giglio, R.F.; Reese, D.J.; Reese, S.L.; Bacon, N.J.; Ellison, G.W. Comparison of Computed Tomographic Angiography and Ultrasonography for the Detection and Characterization of Portosystemic Shunts in Dogs. Vet. Radiol. Ultrasound 2013, 54, 569–574.
- Nelson, N.C.; Nelson, L.L. Anatomy of Extrahepatic Portosystemic Shunts in Dogs as Determined by Computed Tomography Angiography. Vet. Radiol. Ultrasound 2011, 52, 498–506.
- Zwingenberger, A. CT Diagnosis of Portosystemic Shunts. Vet. Clin. N. Am.-Small Anim. Pract. 2009, 39, 783–792.
- Bertolini, G.; Rolla, E.C.; Zotti, A.; Caldin, M. Three-Dimensional Multislice Helical Computed Tomography Techniques for Canine Extra-Hepatic Portosystemic Shunt Assessment. Vet. Radiol. Ultrasound 2006, 47, 439–443.
- Mai, W.; Weisse, C. Contrast-Enhanced Portal Magnetic Resonance Angiography in Dogs with Suspected Congenital Portal Vascular Anomalies. Vet. Radiol. Ultrasound 2011, 52, 284–288.
- Seguin, B.; Tobias, K.M.; Gavin, P.R.; Tucker, R.L. Use of Magnetic Resonance Angiography for Diagnosis of Portosystemic Shunts in Dogs. Vet. Radiol. Ultrasound 1999, 40, 251–258.
- Bruehschwein, A.; Foltin, I.; Flatz, K.; Zoellner, M.; Matis, U. Contrast-Enhanced Magnetic Resonance Angiography for Diagnosis of Portosystemic Shunts in 10 Dogs. Vet. Radiol. Ultrasound 2010, 51, 116–121.
- Christiansen, J.S.; Hottinger, H.A.; Allen, L.; Phillips, L.; Aronson, L.R. Hepatic Microvascular Dysplasia in Dogs: A Retrospective Study of 24 Cases (1987–1995). J. Am. Anim. Hosp. Assoc. 2000, 36, 385–389.
- Schermerhorn, T.; Center, S.A.; Dykes, N.L.; Rowland, P.H.; Yeager, A.E.; Erb, H.N.; Oberhansley, K.; Bonda, M. Characterization of Hepatoportal Microvascular Dysplasia in a Kindred of Cairn Terriers. J. Vet. Intern. Med. 1996, 10, 219–230.

 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург