Продолжение. Начало в № 4/2024
Цель данной статьи: описание и анализ клинического случая тяжелого стеноза клапана аорты молодой собаки, который, вероятнее всего, является следствием бруцеллеза, хотя нельзя было полностью исключить генетическую природу аортального стеноза, что привело к тяжелому кардиогенному отеку, который не поддавался стандартным методам терапии.
Обсуждение
Что явилось причиной резкого развития левосторонней застойной сердечной недостаточности и усугубления аортальной недостаточности, и можно ли все списывать на бруцеллез?Одной из предполагаемых причин могло являться ухудшение систолической функции. С учетом возраста пациента и скорости прогрессирования заболевания идиопатическая дилатационная кардиомиопатия была маловероятной. Рацион пациента составлял коммерческий сбалансированный корм, поэтому дефицит нутриентов был исключен.
Миокардит был возможной причиной ухудшения систолической функции у собаки, недавно приехавшей из приюта и подвергшейся блошиной инвазии. По этой причине пациенту было проведено лабораторное исследование на определение уровня сердечного тропонина I (cTnI), полученный результат которого составил 0,22 нг/мл. По мнению некоторых исследователей, серийные измерения тропонина у собак с подозрением на миокардит дают некоторую прогностическую информацию; снижение значений часто указывает на однократное повреждение и восстановление миокарда, тогда как постоянно повышенные или увеличивающиеся концентрации являются плохим прогностическим показателем38. Не существует общепринятого предельного значения того, насколько серьезным должно быть повышение cTnI, чтобы вызвать клиническое подозрение на наличие инфильтративного или ишемического поражения миокарда. В одном исследовании концентрация cTnI у популяции собак с прижизненно поставленным предположительным диагнозом «миокардит» составляла > 0,2 нг/мл у 100% (29/29) собак, > 1,0 нг/мл у 90% (26/29) собак и > 1,405 нг/мл у 83% (24/29) собак. Данные результаты свидетельствуют о том, что, хотя у большинства собак с клиническим диагнозом «миокардит» значительно повышена концентрация cTnI, в некоторых случаях может наблюдаться более умеренное повышение, потенциально связанное со временем взятия пробы по отношению к повреждению миокарда39. У 6 из 11 собак с гистологически подтвержденным миокардитом и иммуногистохимически выявленной Borrelia burgdorferi в качестве этиологического агента уровни сердечного тропонина I варьировались от 0,25 до 1,7 нг/мл46. В другом исследовании, где гистологически были изучены сердца у собак с АВ-блокадой 3-й степени, у 33,3% посмертно был выявлен лимфоцитарный миокардит. У трех собак с лимфоцитарным миокардитом и АВ-блокадой 3-й степени уровень тропонина варьировался от 0,18 до 3,3 нг/мл (при этом референтный интервал составлял менее 0,02 нг/мл)48.
В нашем случае у пациента не проводилось повторное измерение концентрации тропонина I, однако полученный результат косвенно свидетельствовал о том, что на момент взятия крови острого повреждения миокарда не произошло (хотя оно могло произойти ранее, но к моменту измерения тропонин снизился).
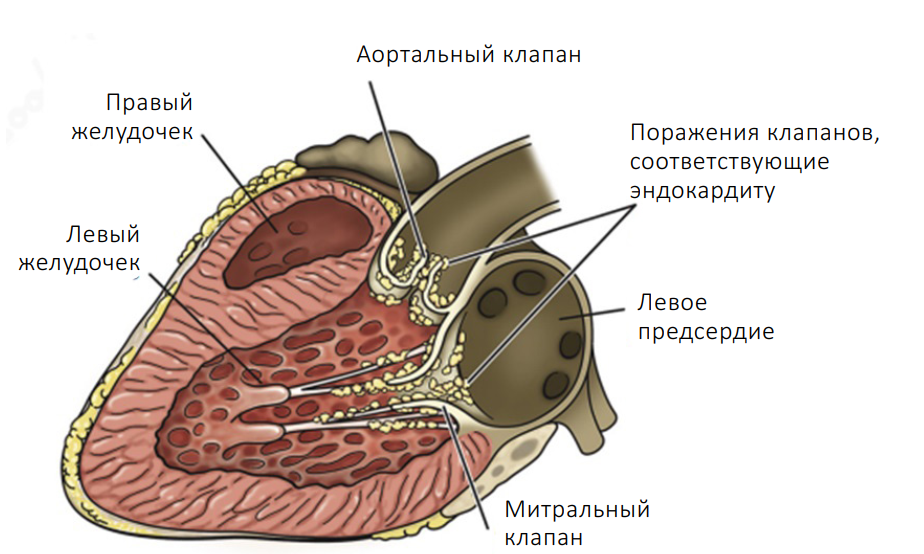
Вторым возможным фактором могло являться усугубление недостаточности клапана аорты на фоне эндокардита (фото 10), что привело к увеличению преднагрузки и постнагрузки левого желудочка, и, следовательно, также могло являться причиной развития сердечной недостаточности.
Скорее всего, поражение клапана было вызвано эндокардитом на фоне бруцеллеза. Не исключено, что у пациента изначально была врожденная патология клапана, которая явилась предрасполагающим фактором к развитию эндокардита. Врожденные пороки сердца, особенно субаортальный стеноз, могут предрасполагать молодых собак к развитию инфекционного эндокардита40.
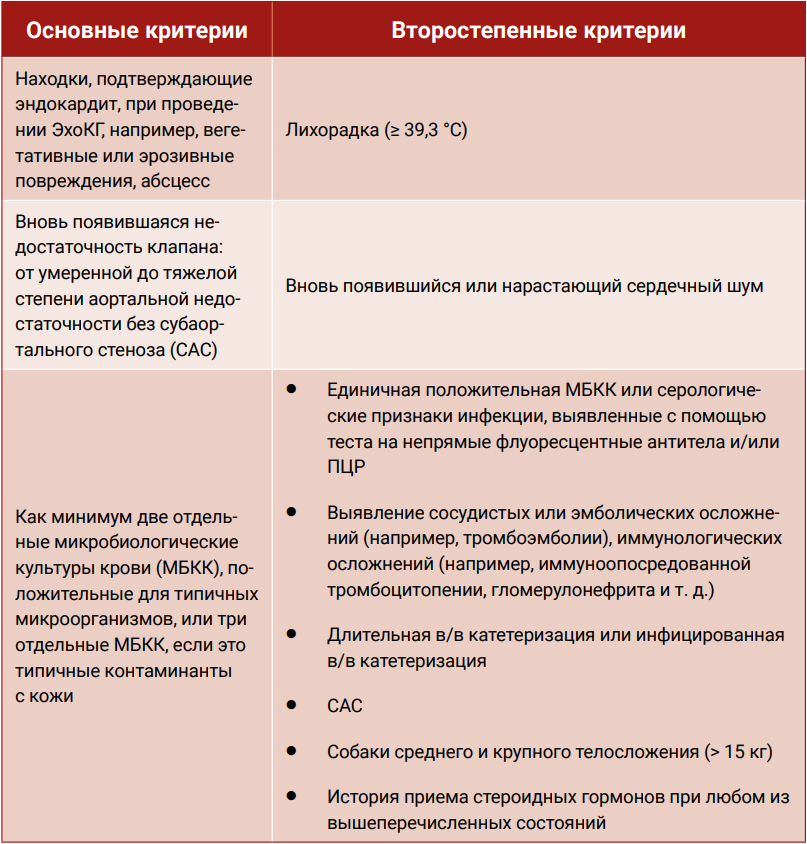
Предполагать у пациента наличие инфекционного эндокардита можно в том случае, если патологическое состояние соответствует модифицированным критериям Дюка (табл. 1). Для постановки окончательного диагноза требуется соответствие как минимум двум основным критериям или одному основному и двум второстепенным критериям, а для постановки предположительного диагноза требуется соответствие одному основному и как минимум одному второстепенному критерию или трем второстепенным критериям41. В описанном случае у пациента было отмечено соответствие следующим критериям: эрозивные повреждения клапана (основной критерий), данные о наличии инфекции, полученные с помощью ПЦР (второстепенный критерий), средний или крупный размер собаки (второстепенный критерий). Также у этого пациента были выявлены данные, которые могут подтверждать инфекционную природу поражения клапана, связанного с Brucella canis. Во-первых, прогрессирование недостаточности аортального клапана может объясняться лишь продолжающимся повреждением клапана; во-вторых, дегенеративные миксоматозные изменения клапана аорты, как правило, выявляются у пожилых собак и связаны с легкой аортальной недостаточностью42. В совокупности со всем вышеперечисленным быстрое прогрессирование недостаточности клапана исключает дегенеративную природу поражений.
Также стоит обратить внимание на то, что в ретроспективном исследовании47 у 79% собак с эндокардитом уровень тропонина превышал контрольный интервал < 0,1 нг/мл. Поскольку cTnI представляет собой внутриклеточный белок миокарда, его повышение в случае инфекционного эндокардита может быть связано с различными факторами: локализованный миокардит, вызванный воспалительными медиаторами; септическая или тромботическая коронарная эмболия; поражение миокарда непосредственно самой инфекцией. Эти механизмы были предложены как возможные причины повышения уровня cTnI у людей47. Достоверно нельзя утверждать, было ли повышение тропонина в описываемом нами случае связано исключительно с эндокардитом. Не исключено, что миокард также мог быть вовлечен в воспалительный процесс. Необходимо уделить некоторое внимание бруцеллезу собак, чтобы понять, что известно об этой болезни из литературных источников.
Бруцеллез собак – это инфекционное и зоонозное заболевание, вызываемое Brucella canis, которое регистрируется во всем мире и представляет собой серьезную проблему для общественного здравоохранения в связи с тесным контактом между собаками и людьми.
B. canis является наиболее распространенной причиной бруцеллеза у собак1, хотя иногда при тесном контакте с тканями или выделениями инфицированных сельскохозяйственных животных (такими как сырое молоко, абортированные плоды и плаценты) возможно случайное заражение собак Brucella melitensis, Brucella abortus или Brucella suis2,3. B. canis была впервые выделена в 1966 г. из абортированных плодов биглей в питомнике США во время вспышки абортов и репродуктивных неудач15. Сейчас существует мнение о всемирной распространенности инфекции B. canis16, но с оговоркой, что на данный момент отсутствуют последовательные эпидемиологические исследования, оценивающие уровень распространенности бруцеллеза собак. Инфицирование собак B. canis регистрировалось во время вспышек заболевания в питомниках4-8 или при проведении серологических исследований бродячих и домашних собак9-14. В недавнем исследовании было обнаружено, что распространенность инфекции B. canis среди собак из приютов составила 2,3%. Однако, согласно полученным данным, уровень заболеваемости в самих приютах может варьироваться от 0 до 8,6%. Это свидетельствует о том, что в некоторых приютах может наблюдаться высокий уровень серологической распространенности бруцеллеза14. Следует напомнить, что наш пациент также был взят из приюта, что могло стать предрасполагающим фактором для заражения бруцеллезом. Это дает основание предполагать, что деформация клапана аорты является приобретенной патологией.
Инфицирование бактерией B. canis может происходить через слизистые оболочки ротовой полости, носа, конъюнктивы и половых органов. Венерическая передача данного патогена является значимым механизмом и осуществляется при выделении микроорганизма со спермой инфицированных собак преимущественно в течение первых 8 недель после заражения. Однако собаки могут продолжать периодически выделять B. canis со спермой на протяжении многих лет17,18. Инфекция также может передаваться от инфицированной суки восприимчивому кобелю при контакте с выделениями из влагалища во время вязки. B. canis может выделяться с мочой у собак обоих полов.
Также наблюдается вертикальная передача заболевания – от матери к плодам. Щенки могут заразиться внутриутробно или после рождения ороназальным путем через загрязненное молоко или контакт с плацентарными оболочками17,19,20. Инфекция B. canis связана с высоким уровнем неонатальной смертности. Выжившие инфицированные щенки могут стать источниками инфекции как постоянные носители B. canis6. Другим потенциальным путем заражения может оказаться переливание крови, поскольку B. canis вызывает периодическую, но стойкую бактериемию15,18.
Заражение человека B. canis впервые было зарегистрировано в 1968 г. и затронуло людей, имевших контакт с инфицированными собаками21. В одном из исследований было выявлено, что клиническое течение бруцеллеза, вызванного B. canis, более скрытое (симптомы могут развиваться незаметно), чем при других видах патогена22, и это подтверждает мнение о том, что заражение бруцеллезом собак может быть недостаточно диагностировано у пациентов-людей. Заражение человека B. canis описано в нескольких странах, но точная распространенность заболевания неизвестна, имеются данные о том, что только 1% случаев диагностированного бруцеллеза человека вызван инфекцией B. canis23, однако частота заражения может быть недооценена.
Заражение человека B. canis осуществляется ороназальным путем при непосредственном контакте с инфицированными собаками, особенно при контакте с контаминированными абортированными плодами или выделениями. Лабораторные манипуляции с возбудителем бруцеллеза без защиты являются еще одним важным источником инфекции. Дети также находятся в группе риска из-за непосредственной близости к домашним собакам24. Бруцеллез человека считается профессиональным заболеванием, поэтому ветеринарные врачи, работники зоомагазинов и питомников, специалисты по уходу за собаками, дрессировщики собак и лаборанты входят в категорию людей с более высоким риском профессионального заражения инфекцией24. Исследование 306 бессимптомных взрослых людей с риском профессионального заражения показало серологическую распространенность B. canis в 3,6%25.
Несмотря на то что B. canis менее патогенна для человека, чем другие виды бруцелл, у пациентов, инфицированных B. сanis, кроме неспецифических симптомов, были описаны такие тяжелые проявления, как эндокардит, аневризма, перитонит, артрит, остеомиелит и эпидуральный абсцесс20. Нейробруцеллез – еще одно важное клиническое проявление заболевания у людей, обычно вызываемое инфекцией B. melitensis, однако имеются сообщения о редких случаях неврологических заболеваний, связанных с инфекцией B. canis26. Также необходимо иметь в виду, что иммунодефицит может быть фактором риска заражения человека B. canis27. Приведенную информацию о заболеваемости у людей (по мнению авторов этой статьи) необходимо знать всем практикующим ветеринарным врачам, и каждому следует самостоятельно принимать решение о том, работать с этой категорией пациентов или нет.
Одной из отличительных особенностей патогенеза B. сanis является то, что эта бактерия вызывает слабую провоспалительную реакцию и, соответственно, приводит к значительному снижению продукции IFNγ (т. е. цитокина, который имеет решающее значение для врожденного и приобретенного иммунитета против вирусных, некоторых бактериальных и протозойных инфекций) и воспалительного ответа22.
Но вернемся к нашим пациентам – собакам.
Клиническая картина
Основным клиническим признаком у большинства собак, инфицированных B. canis, является увеличение лимфатических узлов. В некоторых случаях это заболевание может проявляться репродуктивной недостаточностью. Мертворождение или рождение слабых щенков и смерть новорожденных также часто связывают с инфекцией B. canis15, но в одном помете могут быть и внешне клинически здоровые щенки. Выжившие щенки, являющиеся носителями B.canis, представляют собой потенциальный источник инфекции для людей, находящихся в тесном контакте с ними, и могут являться причиной сохранения бактерий в популяции собак6. Лихорадка не является типичным клиническим признаком у собак, инфицированных естественным или экспериментальным путем. Заражение B. canis обычно остается незамеченным, если у собаки нет репродуктивной активности15; клинические признаки могут появиться только после полового созревания43. Распространенным проявлением бруцеллеза у собак, которое можно выявить при физикальном осмотре, является долговременное увеличение лимфатических узлов, особенно подчелюстных и заглоточных. Придатки семенников могут быть увеличенными и твердыми, с дерматитом мошонки и атрофией семенников. Сообщалось также об орхите при инфекции B. canis. Небольшие абсцессы семенников и увеличение простаты можно визуализировать с помощью УЗИ19. У выживших врожденно инфицированных щенков или собак, инфицированных в более позднем возрасте, могут наблюдаться артрит, заболевания глаз, дискоспондилит, задержка мочи и остеомиелит19.Интерес представляет тот факт, что в опубликованных источниках отсутствуют упоминания об инфекционных эндокардитах, вызванных B. canis, у собак. Однако это не означает, что их не бывает. Существует много упоминаний о поражении эндокарда у людей20. В медицине человека опубликованы данные о том, что бруцеллезный эндокардит, вызванный именно B. canis, с большей вероятностью провоцировал развитие фиброза, гиалинизации и кальцификации пораженного клапана, чем эндокардит, вызванный другими бактериями44. У пациента, представленного в данном клиническом случае, также были выявлены признаки кальцификации створок клапана при проведении эхокардиографии. Однако важно отметить, что эндокардит, вызванный бруцеллезом, встречается редко и его распространенность у людей, больных бруцеллезом, составляет около 1%44. Клинический диагноз «эндокардит» в гуманной медицине также ставится в соответствии с критериями Дюка. Бруцеллезный эндокардит, который является редким заболеванием, становится наиболее частой причиной смерти при бруцеллезе у людей, приводя к тяжелым сердечным осложнениям45.
В ветеринарной медицине эндокардит является достаточно редкой патологией. Причины инфекционного эндокардита (ИЭ) у собак перечислены в табл. 2. Зарегистрированная частота развития ИЭ у собак варьировалась от < 0,1% случаев, оцененных ветеринарными клиниками, до примерно 1% случаев, оцененных ветеринарными кардиологами40. Наиболее распространенными возбудителями ИЭ у собак являются стрептококки, стафилококки и (в меньшей степени) грамотрицательные палочки, энтерококки и Bartonella spp.40 В опубликованном исследовании (Meurs К. М. et al.), целью которого было сравнение чувствительности бактериологического посева крови и ПЦР-диагностики при выявлении возбудителей инфекции у собак с инфекционными эндокардитами28, одним из выявленных патогенов была Brucella spp.; в результатах исследования не было указано название вида, тем не менее возбудитель был идентифицирован. Все перечисленные доводы дают основание предполагать, что инфекционный эндокардит, вызванный B. canis, скорее всего, существует.
Окончательное подтверждение диагноза «бруцеллез» у собак возможно на основании результатов лабораторных исследований.
В своей практике мы используем следующие методы лабораторной диагностики.
- Бактериологический посев. B. canis, как и другие виды Brucella, хорошо растет в аэробных условиях на обычных средах. При отсутствии образцов абортированных плодов или вагинальных выделений в качестве образца для выделения B. canis используется цельная кровь. Образцы спермы и мочи также можно использовать как материал для посева. При наличии увеита, вызванного B. canis, подходящим образцом для посева является внутриглазная жидкость, тогда как в случаях дискоспондилита или остеомиелита образцами выбора являются аспираты костного мозга. Важно отметить, что выделение B. canis с помощью бакпосева имеет низкую чувствительность, что часто приводит к ложноотрицательным результатам29, поэтому всегда рекомендуются дополнительные методы диагностики. И немаловажный момент – лаборатория должна иметь разрешение на выделение возбудителей зооантропонозов.
- Полимеразная цепная реакция (ПЦР). С помощью данного метода генетический материал (ДНК) микроорганизма определяется быстрее, чем культивирование, и на него не влияют жизнеспособность бактерий или загрязнение образца. Цельная кровь является предпочтительным образцом для ПЦР, и, хотя можно также использовать сыворотку, это приводит к более низкой чувствительности30. Образцы спермы и тканей также используют для проведения ПЦР.
- Серологические тесты. Они полезны в диагностических целях, поскольку инфицированные собаки остаются серологически положительными в течение нескольких месяцев даже при отсутствии бактериемии. Например, серологический тест, который используется для диагностики инфекции B. canis в независимой ветеринарной лаборатории «Поиск», – это метод быстрой агглютинации на стекле (MegaRSAT BRUCELLA). Однако нужно иметь в виду, что ложноположительные результаты являются обычным явлением из-за перекрестной реакции с другими бактериями. Независимо от выбранного серологического теста ложноотрицательные результаты обычно наблюдаются в течение первых 3–4 недель после заражения даже при наличии бактериемии. По этой причине собак следует тестировать как минимум дважды с интервалом в 30 дней31.
Терапия
Лечение собак антибиотиками не рекомендуется из-за высокой частоты рецидивов, а также из-за того, что полное выздоровление после такого лечения остается неопределенным, что приводит к высокому риску передачи инфекции людям и другим собакам32,33. Важно подчеркнуть, что антибиотикотерапия не уничтожает полностью B. canis, таким образом, отсутствие клинических признаков после лечения не указывает на отсутствие бактерий34.B. canis, выделенный у собак, обычно чувствителен к доксициклину и тетрациклину, тогда как некоторые штаммы B. canis считаются более устойчивыми к стрептомицину и тетрациклину, чем другие виды Brucella35. Важно отметить, что энрофлоксацин и стрептомицин обладают синергической активностью in vitro против бактерий, тогда как доксициклин и рифампицин обладают антагонистическими эффектами36. Лечение окситетрациклином в течение 4 недель и стрептомицином на 1-й неделе лечения является эффективным у 79% собак, если учитывать устранение бактериемии и отсутствие B. canis в лимфатических узлах, селезенке и репродуктивных органах37.
Выводы:
- Работая с собаками и кошками, не нужно забывать о том, что каждый может встретиться с зооантропонозами и с бруцеллезом в том числе.
- Бруцеллез, вызванный B. canis, вероятно, является слабопатогенным возбудителем для человека, тем не менее человек может им заразиться. Болезнь может протекать бессимптомно и проявляться в периоды иммуносупрессии.
- Сталкиваясь с инфекционным эндокардитом, особенно у молодых собак, необходимо помнить о таком возбудителе, как Brucella, особенно при наличии предрасполагающего анамнеза.
- Тяжелый кардиогенный отек легких может не поддаваться стандартным, консервативным методам терапии, и в таких случаях помогает только искусственная вентиляция легких, которая значительно повышает шансы выживаемости пациентов.
- Carmichael L. E. Brucella canis. In: Nielsen K., Duncan J. R., editors. Animal Brucellosis. Boca Raton, FL: CRC Press (1990). p. 335–50.
- Woldemeskel M. Zoonosis due to Bruella suis with special reference to infection in dogs (Carnivores): a brief review. Open J Vet Med, 3: 213–21, 2013. doi: 10.4236/ojvm.2013.33034
- Baek B. K., Lim C. W., Rahman M. S., Kim C. H., Oluoch A., Kakoma I. Brucella abortus infection in indigenous Korean dogs. Can J Vet Res, 67: 312–4, 2003.
- Morisset R., Spink W. W. Epidemic canine brucellosis due to a new species, Brucella canis. Lancet, 2: 1000–2, 1969.
- Brennan S. J., Ngeleka M., Philibert H. M., Forbes L. B., Allen A. L. Canine brucellosis in a Saskatchewan kennel. Can Vet J, 49: 703–8, 2008.
- Gyuranecz M., Szeredi L., Rónai Z., Dénes B., Dencso L., Dán Á., et al. Detection of Brucella canis-induced reproductive diseases in a kennel. J Vet Diagn Invest, 23: 143–7, 2011. doi: 10.1177/104063871102300127
- Brower A., Okwumabua O., Massengill C., Muenks Q., Vanderloo P., Duster M., et al. Investigation of the spread of Brucella canis via the U.S. interstate dog trade. Int J Infect Dis, 11: 454–8, 2007. doi: 10.1016/j.ijid.2006.12.009
- Hofer E., Bago Z. N., Revilla-Fernndez S., Melzer F., Tomaso H. L, Lopez-Goñi II, et al. First detection of Brucella canis infections in a breeding kennel in Austria. New Microbiol, 35: 507–10, 2012.
- Flores-Castro R., Segura R. A serological and bacteriological survey of canine brucellosis in Mexico. Cornell Vet, 66: 347–52, 1976.
- Lovejoy G. S., Carver H. D., Moseley I. K., Hicks M. Serosurvey of dogs for Brucella canis infection in Memphis, Tennessee. Am J Public Health, 66: 175–176 1976.
- Brown J., Blue J. L., Wooley R. E., Dreesen D. W. Brucella canis infectivity rates in stray and pet dog populations. Am J Public Health, 66: 889–91 1976.
- Dreer M. K. P., Gonçalves D. D., Caetano I. C. S., Gerônimo E., Menegas P. H., Bergo D., et al. Toxoplasmosis, leptospirosis and brucellosis in stray dogs housed at the shelter in Umuarama municipality, Paraná, Brazil. J Venom Anim Toxins Incl Trop Dis, 19: 23, 2013. doi: 10.1186/1678-9199-19-23
- Yoak A. J., Reece J. F., Gehrt S. D., Hamilton I. M. Disease control through fertility control: secondary benefits of animal birth control in Indian street dogs. Prev Vet Med, 113: 152–6, 2014. doi: 10.1016/j.prevetmed.2013.09.005
- Hubbard K., Wang M., Smith D. R. Seroprevalence of brucellosis in Mississippi shelter dogs. Prev Vet Med, 159: 82–6, 2018. doi: 10.1016/j.prevetmed.2018.09.002
- Carmichael L. E., Kenney R. M. Canine abortion caused by Brucella canis. J Am Vet Med Assoc, 152: 605–16, 1968.
- Hensel M. E., Negron M., Arenas-Gamboa A. M. Brucellosis in dogs and Public Health risk. Emerg Infect Dis, 24: 1401–6, 2018. doi: 10.3201/eid2408.171171
- Wanke M. M. Canine brucellosis. Anim Reprod Sci, 82: 195–207, 2004. doi: 10.1016/j.anireprosci.2004.05.005
- Hollett R. B. Canine brucellosis: outbreaks and compliance. Theriogenology, 66: 575–87, 2006. doi: 10.1016/j.theriogenology.2006.04.011
- Makloski C. L. Canine Brucellosis Management. Vet Clin North Am Small Anim Pract, 41: 1209–19, 2011. doi: 10.1016/j.cvsm.2011.08.001
- Marzetti S., Carranza C., Roncallo M., Escobar G. I., Lucero N. E. Recent trends in human Brucella canisinfection. Comp Immunol Microbiol Infect Dis, 36: 55–61, 2013. doi: 10.1016/j.cimid.2012.09.002
- Swenson R. M., Carmichael L. E., Cundy K. R. Human infection with Brucella canis. Ann Intern Med, 76: 435–8, 1972.
- Chacón-Díaz C., Altamirano-Silva P., González-Espinoza G., Medina M. C., Alfaro-Alarcón A., Bouza-Mora L., et al. Brucella canis is an intracellular pathogen that induces a lower proinflammatory response than smooth zoonotic counterparts. Infect Immun, 83: 4861–70, 2015. doi: 10.1128/IAI.00995-15
- Sayan M., Erdenlig S., Stack J., Kilic S., Guducuoglu H.., Aksoy Y., et al. A serological diagnostic survey for Brucella canis infection in Turkish patients with Brucellosis-like symptoms. Jpn J Infect Dis, 64: 516–9, 2011.
- Monroe P. W., Silberg S. L., Morgan P. M., Adess M. Seroepidemiological investigation of Brucella canisantibodies in different human population groups. J Clin Microbiol, 2: 382–6, 1975.
- Krueger W. S., Lucero N. E., Brower A., Heil G. L., Gray G. C. Evidence for unapparent Brucella canis infections among adults with occupational exposure to dogs. Zoonoses Public Health, 61: 509–18, 2014. doi: 10.1111/zph.12102
- Gul H. C., Erdem H., Bek S. Overview of neurobrucellosis: a pooled analysis of 187 cases. Int J Infect Dis, 13: e339–43, 2009. doi: 10.1016/j.ijid.2009.02.015
- Lawaczeck E., Toporek J., Cwikla J., Mathison B. A. Brucella canis in a HIV-infected patient. Zoonoses and Public Health, 58: 150–2, 2011. doi: 10.1111/j.1863-2378.2010.01334.x
- Comparison of Polymerase Chain Reaction with Bacterial 16s Primers to Blood Culture to Identify Bacteremia in Dogs with Suspected Bacterial Endocarditis. J Vet Intern Med, 25(4): 959–62 Jul -Aug, 2011.
- Poester F. P., Nielsen K., Samartino L. E. Diagnosis of brucellosis. Open Vet Sci J, 4: 46–60, 2010.
- Navarro E., Casao M. A., Solera J. Diagnosis of human brucellosis using PCR. Expert Rev Mol Diagn, 4: 115–23, 2004. doi: 10.1586/14737159.4.1.115
- Greene C. E., Carmichael L. E. Canine Brucellosis. In Infectious Diseases of the Dog and Cat, 4th edition, Saunders Elsevier, pp. 398–411, 2012.
- Holst B. S., Löfqvist K., Ernholm L., Eld K., Cedersmyg M., Hallgren G. The first case of Brucella canis in Sweden: background, case report and recommendations from a northern European perspective. Acta Vet Scan, 54: 18, 2012. doi: 10.1186/1751-0147-54-18
- Cosford K. L. Brucella canis: An update on research and clinical management. Can Vet J, 59: 74–81, 2018.
- Wanke M. M., Delpino M. V., Baldi P. C. Use of enrofloxacin in the treatment of canine brucellosis in a dog kennel (clinical trial). Theriogenology, 66: 1573–8, 2006. doi: 10.1016/j.theriogenology.2006.01.034
- Hall W. H., Manion R. E. In vitro susceptibility of Brucella to various antibiotics. Appl Microbiol, 20: 600–4, 1970.
- Mateu-de-Antonio E. M., Martín M. In vitro efficacy of several antimicrobial combinations against Brucella canis and Brucella melitensis strains isolated from dogs. Vet Microbiol, 45:1–10, 1995.
- Zoha S. J., Walsh R. Effect of a two-stage antibiotic treatment regimen on dogs naturally infected with Brucella canis. J Am Vet Med Assoc, 180: 1474–5, 1982.
- Oyama M. A. Using Cardiac Biomarkers in Veterinary Practice. Clin Lab Med, 35(3): 555–66, Sep 2015.
- Lakhdhir S., Viall A., Alloway E., Keene B., Baumgartner K., Ward J. Clinical presentation, cardiovascular findings, etiology, and outcome of myocarditis in dogs: 64 cases with presumptive antemortem diagnosis (26 confirmed postmortem) and 137 cases with postmortem diagnosis only (2004-2017). J Vet Cardiol, 30: 44–56, Aug 2020.
- Davidson A. P., Sykes J. E. Canine Brucellosis. In: Greene’s Infectious Diseases of the Dog and Cat . Fifth Edition. Ed. J Sykes St Louis, Missouri: Elsevier, p. 876–92, 2023.
- Berrezaie M., Connolly D., Cruzado J., Mederska E., Dukes-McEwan J., Humm K. Infective endocarditis in dogs in the UK: 77 cases (2009-2019). J Small Anim Pract, 64(2): 78–87, Feb 2023.
- Fox P. R. Pathology of myxomatous mitral valve disease in the dog. J Vet Cardiol, 14(1): 103–26, Mar 2012.
- Kauffman L. K., Petersen C. A. Canine Brucellosis: Old Foe and Reemerging Scourge. Vet Clin North Am Small Anim Pract, 49(4): 763–779, Jul 2019.
- Li X., Wang T., Wang Y., Xie S., Tan W., Li P. Short- and long-term follow-up outcomes of patients with Brucella endocarditis: a systematic review of 207 Brucella endocarditis Cases. Bioengineered, 12(1): 5162–5172, Dec 2021.
- Du N., Wang F. Clinical characteristics and outcome of Brucella endocarditis. Turk J Med Sci, 46(6): 1729–1733, Dec 20, 2016.
- Janus I., Noszczyk-Nowak A., Nowak M., Cepiel A., Ciaputa R., Pasławska U., Dzięgiel P., Jabłońska K. Myocarditis in dogs: etiology, clinical and histopathological features (11 cases: 2007-2013). Ir Vet J, 67(1): 28 Dec 24, 2014.
- Kilkenny E., Watson C., Dukes-McEwan J., Bode E. F., Hezzell M. J., Payne J. R., Borgeat K. Evaluation of serum cardiac troponin-I concentrations for diagnosis of infective endocarditis in dogs. J Vet Intern Med, 35(5): 2094–2101, Sep 2021.
- Sasaki T., Saeki C., Hirakawa A., Machida N. Pathological Features of Complete Atrioventricular Block in Dogs with Lymphocytic Myocarditis. J Comp Pathol, 174: 18–25, Jan 2020.
- Epstein S. E., Stern J. A., Sykes J. E. Cardiovascular Infections (Bacteremia, Endocarditis, Myocarditis, Infectious Pericarditis In book: Greene's Infectious Diseases of the Dog and Cat, pp. 1590-1602, 2021.


 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург