Ветеринарная клиника доктора Сотникова, г. Санкт-Петербург.
Целью данной статьи является детальное описание клинических проявлений лептоспироза у собак, течения этого заболевания, терапевтических подходов к его лечению и прогнозов, а также анализ ассоциированного с этим заболеванием вторичного гиперальдостеронизма на примере конкретного клинического случая.
Лептоспироз – это инфекционное заболевание, вызываемое патогенными бактериями рода Leptospira, принадлежащими к классу Spirochaetes. Эти грамотрицательные бактерии обладают высокой подвижностью и имеют удлиненную, спиралевидную форму1 (рис. 1).
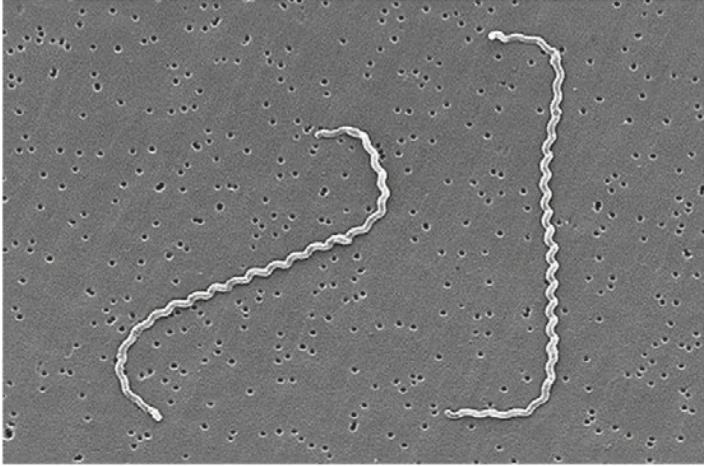 Рис. 1. Изображение спиральных бактерий Leptospira interrogans (штамм RGA), полученное с помощью сканирующего электронного микроскопа (СЭМ). Источник: Public Health Image Library CDC/NCID/Rob Weyant (ссылка)
Рис. 1. Изображение спиральных бактерий Leptospira interrogans (штамм RGA), полученное с помощью сканирующего электронного микроскопа (СЭМ). Источник: Public Health Image Library CDC/NCID/Rob Weyant (ссылка)
Таксономия рода Leptospira довольно сложная. Для наглядного объяснения классификации микроорганизмов на уровне рода, вида и серовара рассмотрим пример бактерии Leptospira interrogans, серовар Australis. Leptospira – это род, interrogans – вид, а Australis – серовар. В некоторых случаях также может указываться штамм, если это применимо к конкретному серовару. Серогруппа – это совокупность антигенно близкородственных сероваров лептоспир. Члены одной серогруппы демонстрируют агглютинацию при инкубации с сывороткой пациента, содержащей антитела, специфичные к соответствующему серовару данной серогруппы.
Лептоспиры могут выживать в течение нескольких месяцев в водной среде и во влажной почве. Заражение случайных хозяев происходит при прямом контакте слизистых оболочек или кожных покровов с мочой инфицированных животных, а также при косвенном контакте с загрязненной почвой или поверхностными водами. В результате у случайных хозяев может развиться острое и тяжелое заболевание.
Резервуарные хозяева, напротив, обычно не демонстрируют никаких клинических признаков после заражения патогенными Leptospira, но могут длительное время сохранять лептоспиры в почечных канальцах, выделяя их с мочой в окружающую среду. Наиболее значимыми резервуарными хозяевами считаются мелкие грызуны. Однако существует вероятность циркуляции патогенных лептоспир среди различных видов грызунов, сумчатых, млекопитающих и даже человека. Резервуарными хозяевами также являются свиньи, крупный рогатый скот, лошади, собаки, овцы, крысы, мыши и летучие мыши2. Клинический лептоспироз распространен у собак, хотя в редких случаях у кошек также могут наблюдаться клинические симптомы лептоспироза3. Однако как собаки, так и кошки могут выделять лептоспиры с мочой, не проявляя клинических признаков заболевания.
На протяжении более 80 лет известно, что собаки являются естественными хозяевами патогенных лептоспир4. Хотя ранее инфекция преимущественно ассоциировалась с наличием антител к серогруппам Canicola и Icterohaemorrhagiae, современные исследования показали, что собаки восприимчивы к широкому спектру сероваров. Анализ данных о распространенности антител выявил, что основными серогруппами, к которым сероконвертируются собаки в Европе, являются Icterohaemorrhagiae, Grippotyphosa, Australis, Sejroe и Canicola5.
Лептоспироз считается сезонным заболеванием, вспышки которого у людей и животных связаны с сильными дождями или наводнениями6. В соответствии с эпидемиологическими данными в США клинически пораженные собаки чаще всего обитают вблизи открытых водоемов, плавают, пьют из них и имеют косвенный контакт с дикими животными, что способствует циркуляции лептоспир в природных экосистемах7.
Клинический случай
Пациент: беспородная кастрированная сука в возрасте 6,5 лет, ежегодно вакцинируемая (сразу необходимо уточнить, что вакцина, которой была привита собака, включала инактивированные лептоспиры серогрупп Canicola, Icterohaemorrhagiae). Обработка от блох и глистов была проведена около четырех месяцев назад. Собака содержится в частном доме со свободным доступом на закрытый участок. Рацион состоит из сухого промышленного корма.Из анамнеза собаки известно, что она была привезена с Кипра в щенячьем возрасте. В возрасте 10 месяцев у животного диагностировали лейшманиоз и эрлихиоз, которые успешно вылечили. С тех пор владельцы регулярно контролируют титр антител к возбудителю лейшманиоза собак (Leishmania spp.).
Дома также содержатся еще две собаки, жалоб на состояние которых на момент поступления пациента на прием к терапевту не было.
Жалобы со стороны владельцев: снижение активности, угнетенное состояние и изменение аппетита, которые наблюдались у питомца в течение двух суток до обращения в ветеринарную клинику. В течение суток до визита к врачу аппетит полностью исчез, а состояние животного ухудшилось: возникла зловонная кашицеобразная пенистая диарея с примесью алой крови, что могло свидетельствовать о толстокишечной диарее. Рвота отсутствовала, жажда и мочеиспускание оставались без особенностей.
В ходе клинического осмотра собаки не было выявлено существенных отклонений от нормы. Гемодинамические показатели оставались стабильными. Из наблюдаемых отклонений можно было выделить только сниженную активность и сниженный тургор кожи. Уровень дегидратации по результатам оценки составил 8%.
Диагностика
У пациента были взяты образцы крови для проведения общеклинического и биохимического анализов, а также для определения уровней С-реактивного белка и иммуноглобулинов IgG к возбудителю лейшманиоза (Leishmania spp.) методом ИФА. Дополнительно образцы кала были отправлены на определение наличия антигенов возбудителей следующих инфекционных заболеваний: парвовирусный энтерит собак (Canine Parvovirus), коронавирусный энтерит собак (Canine Coronavirus), чума плотоядных (Canine Distemper Virus), кампилобактериоз (Campylobacter spp.), клостридиоз, энтеротоксин А (Clostridium perfringens) и сальмонеллез (Salmonella spp.).Было проведено УЗИ брюшной полости, по результатам которого были выявлены следующие изменения:
- локальное умеренное расширение петель тонкого кишечника;
- скудное количество содержимого без эхо-тени с наличием газа в ободочной кишке, утолщение ее стенки до 2,3 мм;
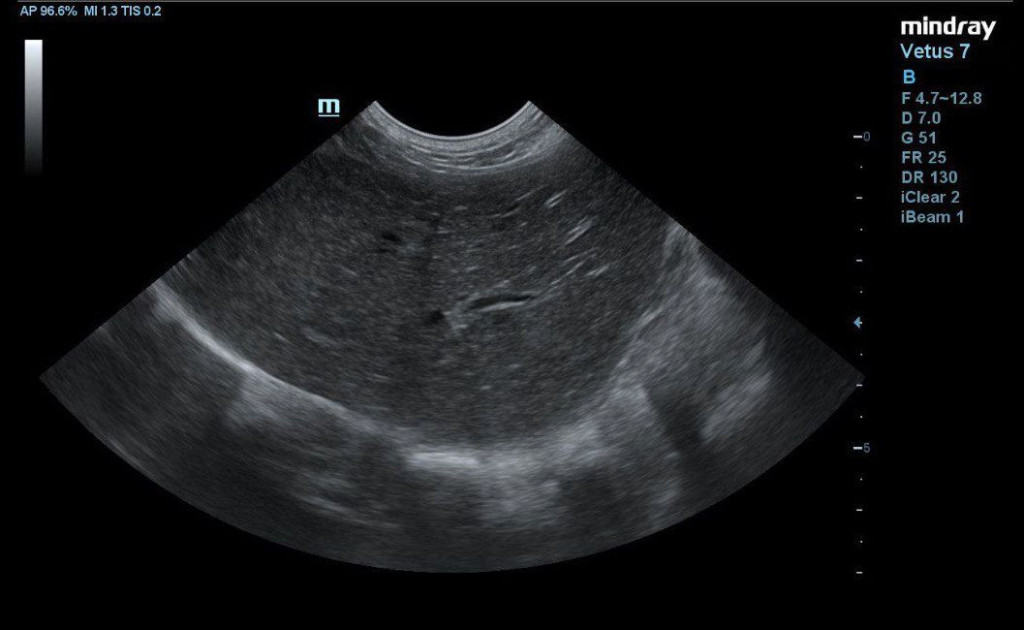
- пониженная эхогенность печени с однородной эхоструктурой и усиленным сосудистым рисунком, что может свидетельствовать о гепатопатии (рис. 2);
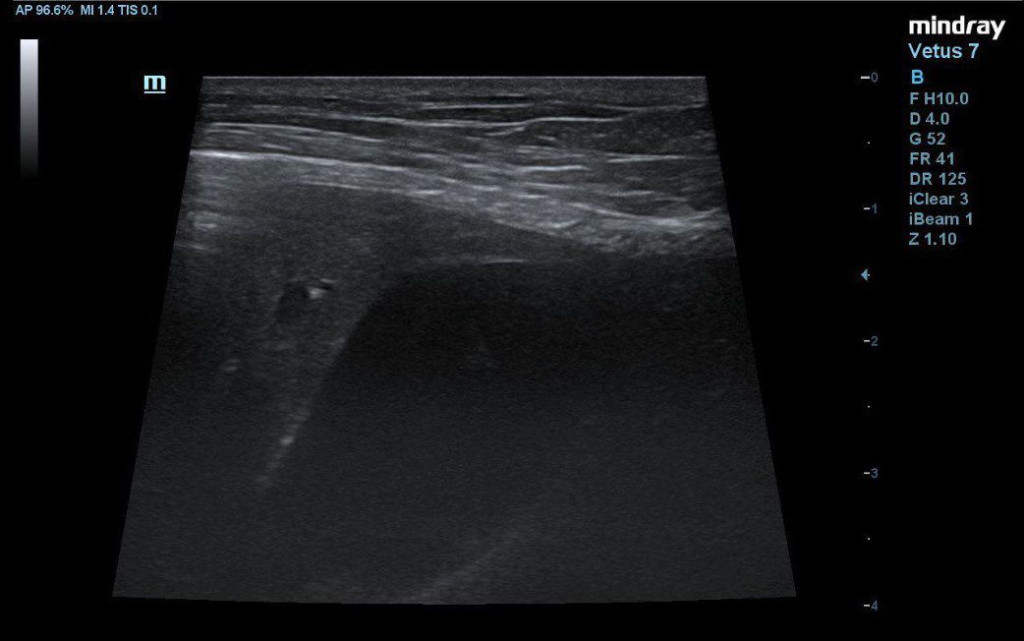
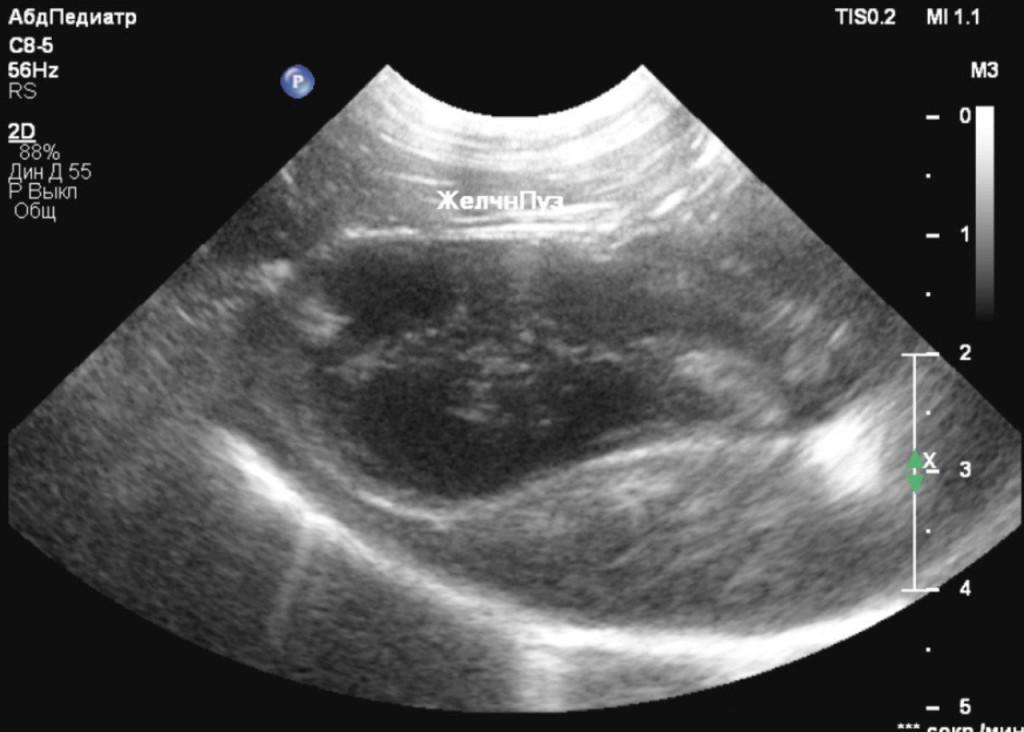
- каплевидная форма желчного пузыря с анэхогенным содержимым и скудным количеством гипоэхогенной взвеси (рис. 3);
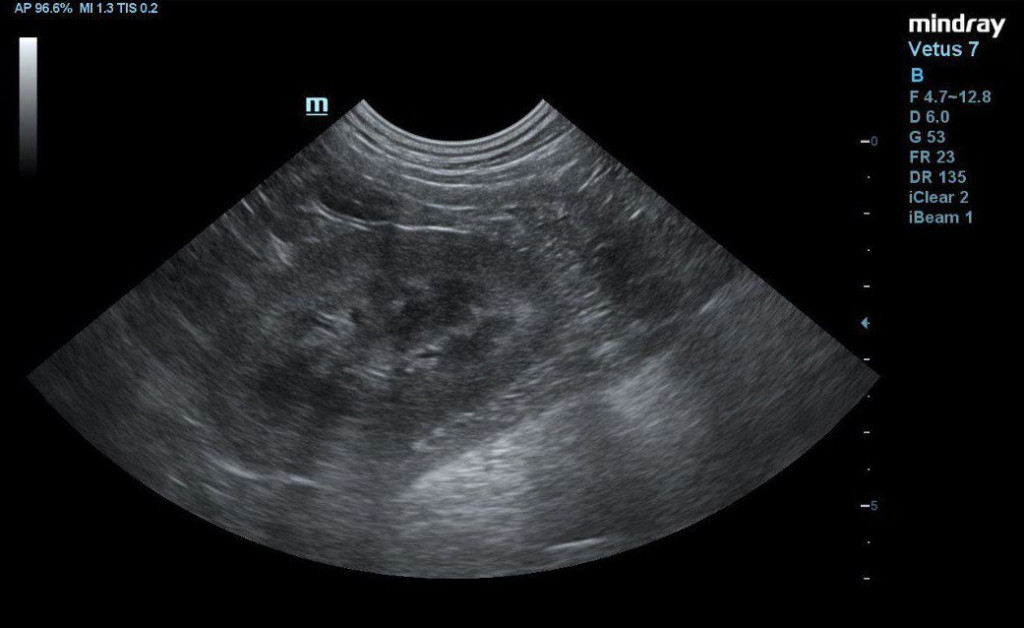
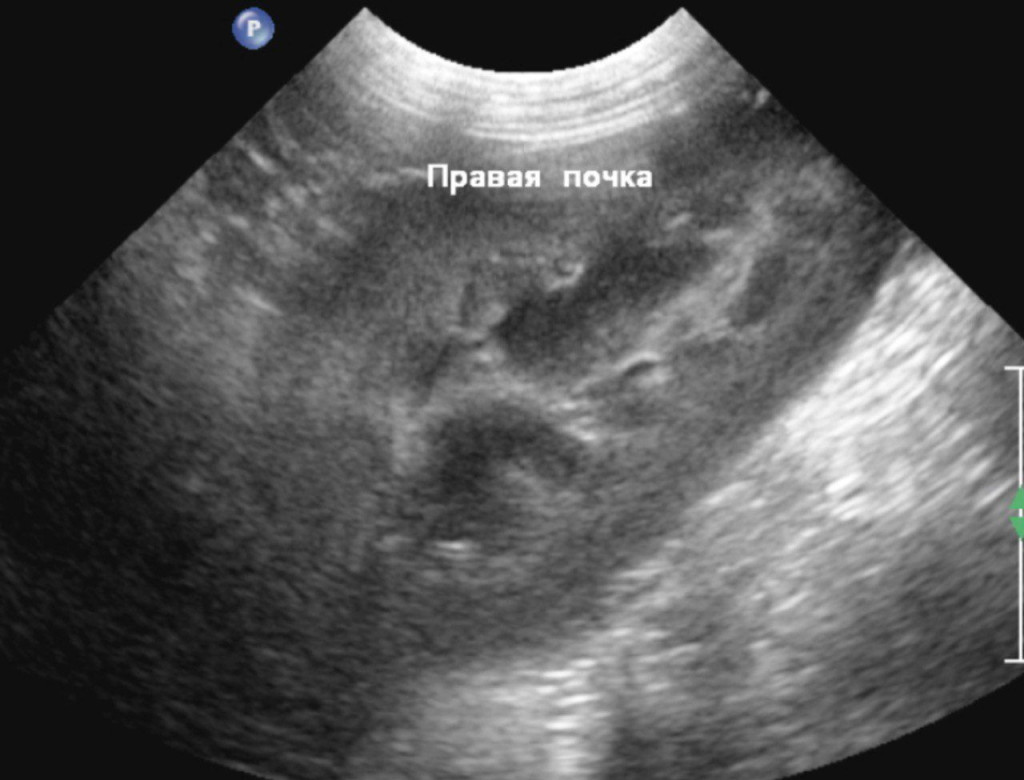
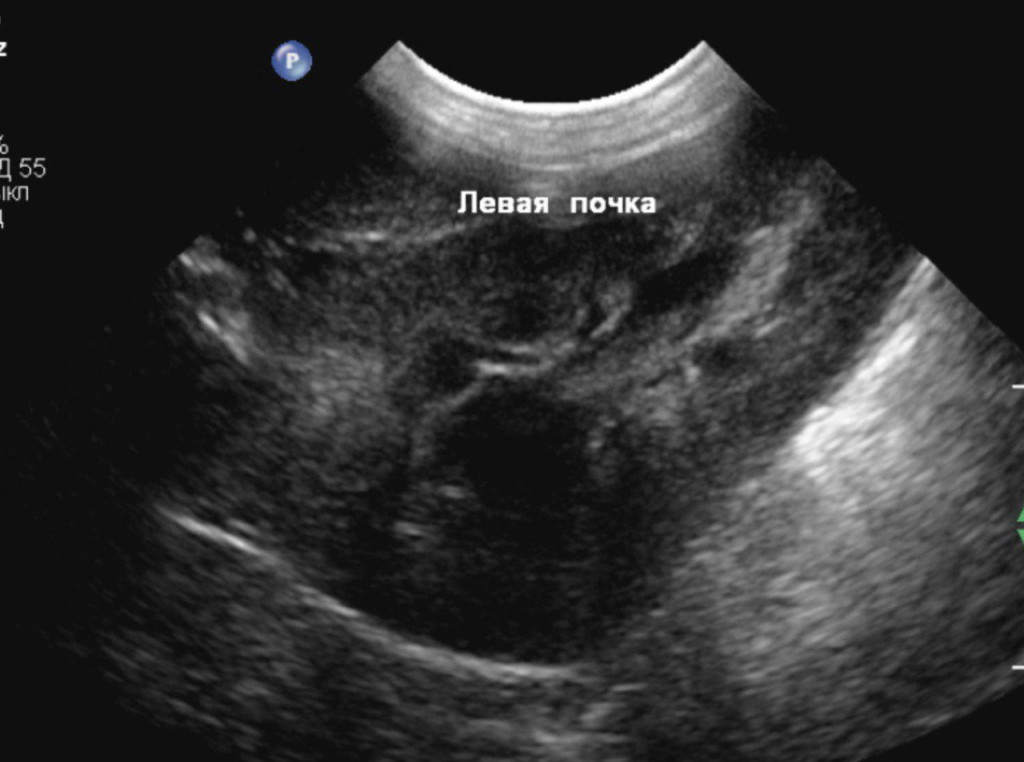
- отсутствие структурных изменений в почках (рис. 4).
Патогенные лептоспиры, проникая в организм хозяина, быстро инициируют системную инфекцию через гематогенное распространение.
В отличие от других грамотрицательных бактерий, вызывающих инфекции кровотока, лептоспиры не приводят к молниеносному развитию заболевания сразу после заражения. Это обусловлено низким эндотоксическим потенциалом липополисахарида лептоспир8. На начальном этапе инфекции лептоспиры избегают иммунного ответа хозяина, связывая ингибиторы активации комплемента на своей поверхности9. Лептоспиремия может продолжаться до тех пор, пока организм не сформирует эффективный приобретенный иммунный ответ, направленный на уничтожение патогенов, их элиминацию из кровотока и большинства тканей организма. После этого лептоспиры могут сохраняться в иммунопривилегированных зонах, таких как глаза и почечные канальцы10.
Инфицирование патогенными лептоспирами может вызывать широкий спектр клинических проявлений, варьирующихся от субклинических форм до тяжелых и потенциально летальных заболеваний.
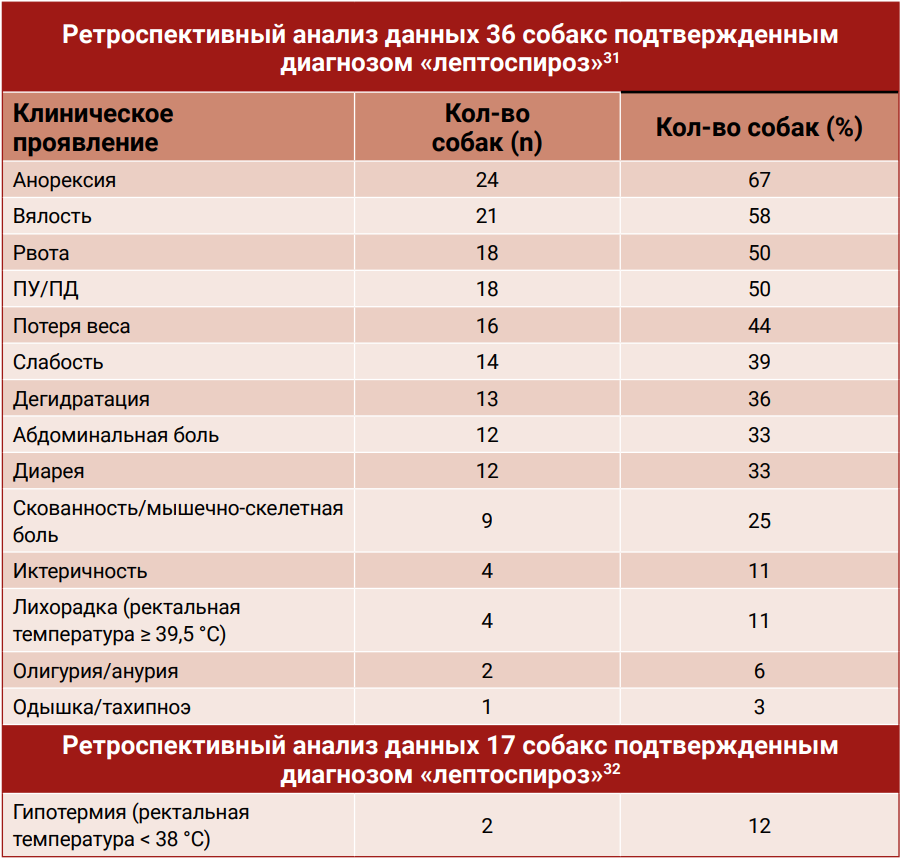
Исход острой инфекции зависит от возраста и иммунного ответа хозяина, а также от вирулентности и размера инокулята патогена10. Инкубационный период, предшествующий развитию клинических симптомов, таких как лихорадка, летаргия и отсутствие аппетита, в экспериментальных исследованиях составляет около семи дней. Однако этот период может варьироваться в зависимости от иммунокомпетентности хозяина, объема инфицирующей дозы и серовара патогена16. Клинические симптомы, которые могут сопровождать лептоспироз, перечислены в табл. 131,32.
Результаты клинического и биохимического анализов крови
Клинический анализ крови выявил следующие отклонения: гемоконцентрация (гематокрит – 55%, реф. зн. – 37–54%), повышение уровня гемоглобина до 189 г/л и эритроцитов до 8,4×1012/л (реф. зн. – 5,4–7,8×1012/л). Эти изменения могли быть следствием диареи и дегидратации. С уверенностью нельзя утверждать, что у собаки была лейкопения: уровень лейкоцитов – 13,8×109/л (реф. зн. 6–17×109/л), палочкоядерных нейтрофилов при этом 0,39х109/л (реф. зн. 0,0 – 0,3х109/л), однако это количество лейкоцитов было расценено как относительная лейкопения из-за возможного наличия воспаления в кишечнике. Также была выявлена тромбоцитопения при ручном подсчете (87,0×109/л при референсном интервале 160,0–430,0×109/л). Согласно литературным данным, примерно у половины собак с лептоспирозом наблюдается анемия, чаще легкая или умеренная. У большинства животных с лептоспирозом обнаруживается лейкоцитоз с количеством лейкоцитов до 40×109/л. В ходе заболевания были зафиксированы лейкемоидные реакции с уровнем лейкоцитов > 80×109/л17. В фазе лептоспиремии может наблюдаться лейкопения. При дифференциальном подсчете клеток часто выявляются нейтрофилия (иногда со сдвигом влево), лимфопения и моноцитоз. У собак с лептоспирозом часто встречается легкая или тяжелая степень тромбоцитопении. Однако на тот момент у нас было недостаточно данных, чтобы подозревать лептоспироз. Низкий уровень тромбоцитов при лептоспирозе может быть обусловлен их потреблением вследствие активации, адгезии и агрегации на поврежденном сосудистом эндотелии, фагоцитоза клетками Купфера, иммуноопосредованного разрушения или селезеночной секвестрации22. Имеются также данные, полученные in vitro, о прямом цитотоксическом действии патогенных лептоспир на тромбоциты28.В биохимическом профиле пациента отмечалось значительное повышение уровней креатинина (308,4 мкмоль/л при норме 44,0–120,0 мкмоль/л), мочевины (40,23 ммоль/л при норме 4,0–8,0 ммоль/л) и фосфора (2,34 ммоль/л при норме 0,9–2,0 ммоль/л). На данном этапе не было однозначно понятно, связано ли это повышение с истинным почечным повреждением или являлось преренальной азотемией, однако больше склонялись к ренальной азотемии, поскольку повышение уровней креатинина и мочевины было значимым, кроме того, повышение концентрации фосфора нехарактерно для преренального компонента. Также в биохимическом профиле наблюдалось повышение содержания глобулинов (36,63 г/л при норме 27,0–35,0 г/л), что могло свидетельствовать о длительном воспалении. Повышение активности креатинкиназы (2306,6 МЕ/л при норме 0,0–500,0 МЕ/л), аланинаминотрансферазы (129,0 МЕ/л при норме 10,0–80,0 МЕ/л), аспартатаминотрансферазы (150,3 МЕ/л при норме 10,0–60,0 МЕ/л) и щелочной фосфатазы (368,5 МЕ/л при норме 20,0–150,0 МЕ/л) связать с чем-то определенным также было затруднительно, поскольку они могут выбрасываться в кровоток при большом количестве патологий, включая колит и изменения паренхимы печени. Гипокалиемия (3,19 ммоль/л при норме 3,2–5,5 ммоль/л) была интерпретирована как следствие потерь с диареей. Результат С-реактивного белка составил 26,49 мг/л при референсных значениях 0,0–10,0 мг/л, что также свидетельствовало о наличии воспаления, локализация которого казалась очевидной.
Спустя примерно 12 часов после окончания приема у терапевта владельцы собаки сообщили по телефону об отсутствии улучшений в общем состоянии питомца. С учетом полученных результатов анализов владельцам было рекомендовано размещение питомца в ОРИТ.
Лечение
При первичном осмотре собаки, поступившей в стационар, ее общее и гемодинамическое состояние не отличалось от результатов предыдущего осмотра. В связи с выявленной тромбоцитопенией были отобраны образцы крови для выявления антигенов возбудителей бабезиоза (Babesia spp.), эрлихиоза (Ehrlichia spp.), гранулоцитарного анаплазмоза (Anaplasma phagocytophilum) и тромбоцитарного анаплазмоза (Anaplasma platys) методом ПЦР. Также была взята сыворотка крови для определения уровня антител класса IgG к возбудителям анаплазмоза собак (Anaplasma platys и Anaplasma phagocytophilum) и эрлихиоза (Ehrlichia canis) методом ИФА. До получения результатов лабораторных исследований было начато лечение доксициклином в дозе 5 мг/кг 2 раза в день перорально. В связи с выявленной гиперфосфатемией был назначен препарат «Алмагель», который вводился перорально в дозе 70 мг/кг в сутки, разделенной на несколько приемов. Инфузионная терапия была рассчитана и начата (внутривенно) в стационарных условиях с целью коррекции дегидратации и восполнения потерь жидкости, обусловленных диареей. Восполнение дефицита калия осуществлялось путем инфузии 4%-го р-ра хлорида калия (KCl) в дозе 0,8 мл/кг/час в течение 4 часов под контролем анализов крови.На следующий день были получены результаты анализов на инфекции, включая ПЦР и ИФА. Исследования показали отрицательные результаты для всех инфекций за исключением кампилобактериоза (Campylobacter spp.), который был положительным, но его клиническая значимость вызывала сомнения. Уровень коэффициента К, используемого при исследовании на IgG к возбудителю лейшманиоза (Leishmania spp.) методом ИФА, составил 13,9 (реф. зн. < 9 – отрицательный результат, 9–11 – сомнительный, > 11 – положительный). У данной собаки после завершения курса лечения и исчезновения клинических симптомов лейшманиоза этот коэффициент обычно составлял 15–19. Клиническое состояние собаки оставалось прежним за исключением улучшения тургора кожи, отсутствия стула за последние сутки и проявления дискомфорта при пальпации в области эпигастрия. Темп диуреза не был подсчитан, но на трехкратной прогулке за сутки собака мочилась, между прогулками в стационаре мочеиспускание отсутствовало, поэтому субъективно объем мочи был расценен как нормальный. По результатам общеклинического анализа крови тромбоцитопения сохранялась (45,0×109/л при реф. зн. 160,0–430,0), лейкоциты и гематокрит находились в норме, хотя значения лейкоцитов и лейкоформулы вызывали сомнения. Биохимический профиль показал значительные изменения по сравнению с днем поступления: увеличилась активность аланинаминотрансферазы (с 129,0 МЕ/л до 2656,1 МЕ/л, реф. зн. 10,0–80,0), аспартатаминотрансферазы (с 150,3 МЕ/л до 1336,8 МЕ/л, реф. зн 10,0–60,0), щелочной фосфатазы (с 368,5 МЕ/л до 5084,3 МЕ/л, реф. зн. 20,0–150,0), гамма-глутамилтрансферазы (до 48,7 МЕ/л, реф. зн. 0,0–10,0), глутаматдегидрогеназы (до 934,3 МЕ/л, реф. зн. 0,0–12,0); повысились уровни холестерина (до 7,29 ммоль/л, реф. зн. 3,5–7,0), общего билирубина (до 151,58 мкмоль/л, реф. зн. 0,0–12,0); снизились уровни креатинина (до 128,8 мкмоль/л, реф. зн. 44,0–120,0), мочевины (до 20,89 ммоль/л, реф. зн. 4,0–8,0), фосфора (до 1,38 ммоль/л, реф. зн. 0,9–2,0). Калий, несмотря на инфузию KCl и отсутствие диареи, оставался ниже референсных значений (2,16 ммоль/л, реф. зн. 3,2–5,5).
При повторном ультразвуковом исследовании почек (рис. 5, 6) не наблюдалось значительных изменений за исключением слабовыраженной пиелоэктазии на фоне инфузионной терапии. Паренхима печени также не демонстрировала динамики по сравнению с предыдущим ультразвуковым исследованием, однако желчный пузырь имел некоторые изменения: он был овальной формы с размерами 38,8×20,2 мм и утолщенной стенкой до 1,6 мм. Содержимое просвета пузыря было смешанной эхогенности. Конкременты не визуализировались. На основании этих данных у нас возникло предположение о формировании мукоцеле желчного пузыря, хотя также нельзя было исключать холецистит.
В связи с наличием азотемии и гиперфосфатемии при поступлении, а также тромбоцитопении, роста печеночных показателей и изменений при ультразвуковой диагностике у пациента была отобрана моча для определения наличия антигенов лептоспироза (Leptospira spp.) методом ПЦР, а также сыворотка крови для выявления специфических антител к лептоспирам методом реакции микроагглютинации (РМА). Дополнительно была отобрана моча для проведения общего клинического анализа и парциальной экскреции калия с мочой. Результаты общего клинического анализа мочи не выявили значимых отклонений за исключением сниженной плотности (1,019 г/л, реф. зн. 1,030–1,050 г/л), что могло быть обусловлено инфузионной терапией и требовало осторожной интерпретации. Также наблюдалась глюкозурия (3,0 ммоль/л), это могло свидетельствовать о повреждении почечных клубочков и, в сочетании с азотемией, указывало на возможное непосредственное повреждение почек. Парциальная экскреция калия с мочой была повышена (23,53% при реф. зн. 0–20%), что в сочетании с гипокалиемией послужило основанием для проведения анализа крови на рениновую активность (PRA) и концентрацию альдостерона.
До получения результатов этих исследований пациенту был назначен препарат «Спиронолактон» в дозировке 3 мг/кг 1 раз в день перорально.
Точные механизмы, посредством которых патогенные лептоспиры вызывают дисфункцию органов и повреждение тканей, остаются недостаточно изученными и могут варьироваться в зависимости от пораженной системы органов.
В острой фазе лептоспироза наблюдаются преимущественно поражения почек, характеризующиеся острым интерстициальным нефритом с некрозом канальцевых клеток, апоптозом и регенерацией11. Тем не менее у собак и экспериментальных животных с лептоспирозом также описаны гломерулярные аномалии, что указывает на структурные и функциональные нарушения клубочков12. Предполагается, что поражения канальцев обусловлены прямым воздействием микроорганизмов, поскольку поражения почек обычно связаны с присутствием Leptospira11, а компоненты внешней мембраны лептоспир, как было показано, вызывают повреждение клеток и воспаление в эпителиальных клетках канальцев in vitro13.
Во время этой фазы развития инфекционного процесса клинически значимое снижение функции почек наблюдается у большинства (но не у всех) пациентов с лептоспирозом10. Клинические признаки, связанные с поражением почек, включают полидипсию и полиурию (ПУ/ПД), которые могут развиваться с наличием или отсутствием сопутствующей азотемии. Лептоспиры могут вызывать специфическую гипокалиемическую, неолигурическую форму острой почечной недостаточности. При лептоспирозе у собак часто наблюдаются нарушения электролитного баланса, такие как гипо- и гиперкалиемия, гипо- и гиперфосфатемия, гипонатриемия и гипохлоремия. Гипокалиемия может возникнуть из-за почечных и/или желудочно-кишечных потерь, а также из-за индуцированного лептоспирами ингибирования Na+-K+-АТФазы24. Сообщалось, что олигурическая/анурическая почечная недостаточность развивается примерно у 30% собак с острым лептоспирозом14. Определение роли лептоспироза в развитии хронической болезни почек (ХБП) у кошек и собак требует проведения дальнейших исследований.
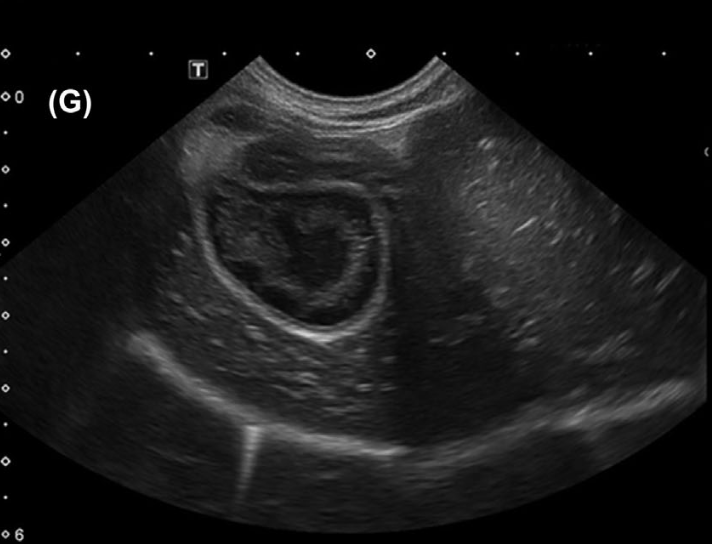
Печень является еще одним важным органом, который может быть поражен лептоспирами. Гистопатологические исследования выявляют холестатический гепатит с полным или частичным разрушением печеночной пластинки, гепатоцеллюлярный некроз, бинуклеацию гепатоцитов, перипортальный отек с острой и хронической воспалительной клеточной инфильтрацией и пролиферацией клеток Купфера вдоль синусоидальной выстилки10. Желтушная форма лептоспироза характеризуется более тяжелым и быстро прогрессирующим течением. В одном исследовании с участием 254 собак с острым лептоспирозом было установлено, что повышение уровня билирубина до 10 мкмоль/л и выше (реф. зн. 0,5–4,0 мкмоль/л) связано с неблагоприятным исходом (смерть или эвтаназия)14. Поражение печени может варьироваться от легкого повышения уровня печеночных ферментов с наличием или отсутствием гипербилирубинемии до тяжелой печеночной недостаточности с признаками энцефалопатии18. Повышение активности аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и щелочной фосфатазы (ЩФ), а также гипербилирубинемия чаще всего наблюдаются в сочетании с азотемией23. На данный момент не установлено, может ли Leptospira spp. выступать в качестве возбудителя хронического гепатита у собак, однако в литературе имеются данные о развитии мукоцеле желчного пузыря у собак с диагностированным лептоспирозом. В одном из исследований с участием 35 собак УЗИ-признаки мукоцеле были обнаружены у 9 животных (рис. 7)29.
Анализ мочи выявляет изостенурию у большинства собак с лептоспирозом, однако (по опубликованным данным) также может наблюдаться гипостенурия25. Глюкозурия возникает вторично по отношению к острому повреждению канальцев и может сопровождаться гематурией, пиурией и наличием зернистых цилиндров22. Протеинурия присутствует у большинства собак. Микроскопия в темном поле для выявления лептоспир в моче имеет низкую чувствительность и требует использования свежей мочи.
Лептоспироз может сопровождаться панкреатитом, что может объяснить острый дискомфорт в животе, а также анорексию и рвоту у собак, у которых азотемия и гипербилирубинемия разрешились18. Возможна также кишечная инвагинация как осложнение острого лептоспироза, предположительно, связанная с воспалением желудочно-кишечного тракта и нарушениями моторики19. Признаки нарушения гемостаза, такие как кровохарканье, носовое кровотечение, кровавая рвота, гематохезия, мелена, гематурия и петехии, были признаны связанными с лептоспирозом у собак12. Электрокардиографические отклонения, такие как желудочковые тахиаритмии и повышение концентрации тропонина в сыворотке у некоторых собак с лептоспирозом, указывают на повреждение миокарда12. Офтальмологические аномалии, включая повышенную слезопродукцию, слизисто-гнойные выделения из глаз, снижение зрачковых рефлексов, конъюнктивит, панувеит, инъекцию склеры, гифему, отек диска зрительного нерва, отслоение сетчатки и кровоизлияния, также часто наблюдаются у собак с лептоспирозом20. Сообщалось, что у молодых собак с лептоспирозом развиваются тяжелые системные или кожные кальцификации21. Заболевание также связано с бесплодием и абортами у собак. Повышение активности креатинкиназы и АСТ, а также тропонина I было отмечено у 44 и 69% собак с лептоспирозом, что связано с повреждением скелетной мускулатуры и миокарда25. Увеличение активности амилазы и липазы может быть связано с панкреатитом или энтеритом, но также может отражать снижение почечной экскреции этих ферментов. У собак с острым лептоспирозом были зарегистрированы различные отклонения гемостатических параметров, указывающие на то, что могут возникать как гипер-, так и гипокоагуляционные состояния25.
На третьи сутки нахождения в стационаре общее состояние нашего пациента оставалось прежним. Несмотря на инфузионную терапию и прием антибиотиков, собака была угнетенной, малоактивной, с дискомфортом в эпигастральной области и отсутствием аппетита. Стул по-прежнему отсутствовал. Уровень калия в крови нормализовался, что позволило прекратить инфузии хлорида калия. Азотемия почти разрешилась: уровни креатинина и фосфора пришли в норму, а уровень мочевины снизился до 13,62 ммоль/л (реф. зн. 4,0–8,0 ммоль/л). Повышение активности трансаминазы, щелочной фосфатазы, глутаматдегидрогеназы, а также уровней холестерина и билирубина сохранялось почти без изменений по сравнению с предыдущим днем. По данным УЗИ размер желчного пузыря увеличился до 52,3×23,9 мм (рис. 8), а в его полости обнаружились многочисленные гиперэхогенные, неподвижные тяжи, характерные для мукоцеле.
На основании сохраняющегося неудовлетворительного состояния пациента, наличия болезненности в эпигастральной области, отсутствия динамики печеночных показателей крови и ухудшения состояния желчного пузыря по данным УЗИ было принято решение о проведении холецистэктомии. В процессе операции был осуществлен забор желчи для цитологического исследования и бакпосева, а также были отобраны образцы печени для гистологического исследования, бакпосева и определения наличия антигенов кампилобактериоза (Campylobacte) и бартонеллеза (Bartonella henselae и Bartonella vinsonii) методом ПЦР.
Продолжение в следующем номере
Список литературы:
- Faine S., Adler B., Bolin C., et al. Leptospira and Leptospirosis. 2nd ed. Melbourne: MediSci, 1999.
- Ganoza C. A., Matthias M. A., Saito M., et al. Asymptomatic renal colonization of humans in the peruvian Amazon by Leptospira. PLoS Negle Trop Dis, 2010.
- Arbour J., Blais M. C., Carioto L., et al. Clinical leptospirosis in three cats (2001-2009). J Am Anim Hosp Assoc, 2012.
- Klarenbeek A., Schuffner W. A. P. Appearance in Holland of Leptospira differing from Weil Strain. Nederlands Tijdschrift voor Geneeskunde, 1933.
- Ellis W. A. Control of canine leptospirosis in Europe: time for a change? Vet Rec, 2010.
- Ward M. P. Seasonality of canine leptospirosis in the United States and Canada and its association with rainfall. Prev Vet Med, 2002.
- Ghneim G. S., Viers J. H., Chomel B. B., et al. Use of a case-control study and geographic information systems to determine environmental and demographic risk factors for canine leptospirosis. Vet Res, 2007
- Werts C., Tapping R. I., Mathison J. C., et al. Leptospiral lipopolysaccha-ride activates cells through a TLR2-dependent mechanism. Nat Immunol, 2001.
- Meri T., Murgia R., Stefanel P., et al. Regulation of complement activation at the C3-level by serum resistant leptospires. Microb Pathog, 2005.
- Levett P. N. Leptospirosis. Clin Microb Rev, 2001.
- De Brito T., Menezes L. F., Lima D. M., et al. Immunohistochemical and in situ hybridization studies of the liver and kidney in human leptospirosis. Virchows Archiv, 2006.
- Mastrorilli C., Dondi F., Agnoli C., et al. Clinicopathologic features and outcome predictors of Leptospira interrogans Australis serogroup infection in dogs: a retrospective study of 20 cases (2001-2004). J Vet Intern Med, 2007.
- Yang H. L., Jiang X. C., Zhang X. Y., et al. Thrombocytopenia in the experimental leptospirosis of guinea pig is not related to disseminated intravascular coagulation. BMC Infect Dis, 2006.
- Major A., Schweighauser A. & Francey T. Increasing incidence of canine leptospirosis in Switzerland. Int J Environ Res Public Health, 2014.
- Nally J. E., Chantranuwat C., Wu X. Y., et al. Alveolar septal deposition of immunoglobulin and complement parallels pulmonary hemorrhage in a guinea pig model of severe pulmonary leptospirosis. Am J Pathol, 2004.
- Greenlee J. J., Alt D. P., Bolin C. A., et al. Experimental canine leptospirosis caused by Leptospira interrogans serovars pomona and bratislava. Am J Vet Res, 2005.
- Kohn B., Steinicke K., Arndt G., et al. Pulmonary abnormalities in dogs with leptospirosis. J Vet Intern Med, 2010.
- Greene E. C. Leptospirosis. In: Infectious Diseases of the Dog and Cat. 4th Ed. C. E. Greene. Elsevier, pp. 431-447, 2012.
- Schulz B. S., Seybold N., Adamik K. N., et al. Ileocolic intestinal intussus-ception in a dog with leptospirosis. Tierarztliche Praxis Ausgabe K: Kleintiere Heimtiere, pp. 403-405, 2010.
- Townsend W. M., Stiles J. & Krohne S. G. Leptospirosis and panuveitis in a dog. Vet Ophthalmol, 2006.
- Michel E., Kook P. H., Voss K., et al. [Generalized metastatic intestinal and cutaneous calcinosis in a Hovawart puppy with leptospirosis]. Schweiz Arch Tierheilkd, 2011.
- Kohn B., Engelbrecht R., Leibord W. Clinical findings, diagnostics and treatment results in primary and secondary immune-mediated thrombocytopenia in the dog. Kleintierpraxis, 2000.
- Geisen V., Stengel C., Brem S., et al. Canine leptospirosis infections – clinical signs and outcome with different suspected Leptospira serogroups (42 cases). J Small Anim Pract, 2007.
- Goldstein R. E., Lin R. C., Langston C. E., et al. Influence of infecting serogroup on clinical features of leptospirosis in dogs. J of Vet Intern Med, 2006.
- Mastrorilli C., Dondi F., Agnoli C., et al. Clinicopathologic features and outcome predictors of Leptospira interrogans Australis serogroup infection in dogs: a retrospective study of 20 cases (2001-2004). J Vet Intern Med, 2007.
- Baumann D. & Fluckiger M. Radiographic findings in the thorax of dogs with leptospiral infection. Vet Radiol Ultrasound, 2001.
- Jane E. Sykes et al. Updated ACVIM consensus statement on leptospirosis in dogs. J Vet Intern Med, 2023
- Vieira M. L., Nascimento A. Virulent Leptospira interrogans induce cytotoxic effects in human platelets in vitro through direct interactions. Front Microbiol, 2020.
- Juliette Sone et al. Prospective evaluation of abdominal ultrasonographic findings in 35 dogs with leptospirosis. Vet Radiol Ultrasound, 2018.
- Alejandro Dominguez, Vijayadershan Muppidi, Stephen W. Leslie, Sonu Gupta. Hyperaldosteronism, 2024.
- Birnbaum N. et al. Naturally acquired leptospirosis in 36 dogs: serological and clinicopathological features. J Small Anim Pract, 1998.
- Rentko V. T., et al. Canine leptospirosis. A retrospective study of 17 cases. J Vet Intern Med, 1992.

 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург