Список сокращений:
ИПК – инфекционный перитонит кошек;
ММ – множественная миелома;
ОЛЛ – острый лимфобластный лейкоз;
ХВИ – хронические вирусные инфекции;
ХЛЛ – хронический лимфолейкоз;
ЦК – цельная кровь;
ЭМП – экстрамедуллярная плазмоцитома.
Миеломная болезнь (множественная миелома) относится к плазмоцитарным опухолям, образующимся в результате пролиферации клеток В-клеточной линии дифференцировки.
ММ составляет около 8% всех гемопоэтических опухолей у собак, у кошек частота возникновения и развития ММ неизвестна. Болезнь развивается у животных старшего возраста, породной и половой предрасположенности не выявлено.
Этиология ММ по большей части неизвестна. В качестве способствующих возникновению ММ факторов были предложены генетическая предрасположенность, молекулярные аберрации (например, c-kit), вирусные инфекции, хроническая иммунная стимуляция и воздействие канцерогенов1. Сообщалось о прогрессировании В-клеточной лимфомы и солитарных плазматических опухолей до ММ у собак и кошек2-3.
У кошек связь между ММ и вирусами, такими как вирус лейкемии кошек (FeLV) и вирус иммунодефицита кошек (FIV), не выявлена, но диагностика заболевания у самок и самцов однопометников предполагает наличие родственной связи4.
Патогенез обусловлен инфильтрацией систем органов (включая костный мозг) и патологически высоким уровнем циркулирующего М-компонента, что приводит к развитию широкого спектра патологических проявлений и связанных с ними клинических синдромов5. Миелома у кошек, иногда определяемая как «родственные миеломе расстройства», в большинстве случаев характеризуется поражением костного мозга, при этом у кошек чаще, чем у собак, выявляются экстрамедуллярные локализации (кожа, органы брюшной полости)4,6-9.
Экстрамедуллярные плазмоцитомы (ЭМП) представляют собой моноклональные пролиферации терминально дифференцированных В-клеток, которые не затрагивают костный мозг. Это редкое новообразование у кошек в большинстве случаев локализуется в кожных покровах10, хотя имеются сообщения об иных локализациях, в том числе синоназальных11, желудочно-кишечных12, церебральных13, внутриглазных14, а также оральных (ткани губ и десен)15. За исключением случаев внутримозгового и синоназального распространения большинство ЭМП описаны как четко очерченные образования, не имеющие воспалительной природы возникновения.
Клинические признаки:
- У собак – апатия, вялость, хромота, кровотечения, полиурия и полидипсия, нарушения со стороны ЦНС.
- У кошек – анорексия, снижение массы тела, хромота, органомегалия из-за инфильтрации органов опухолевыми клетками (табл. 1).
Диагностика
Для постановки диагноза ММ необходимо провести ряд исследований:- клинический анализ крови с ручным подсчетом тромбоцитов;
- биохимический анализ крови, определение уровня ионизированного кальция;
- общий анализ мочи;
- исследование костного мозга;
- обзорный рентген костных структур;
- УЗИ брюшной полости;
- КТ-неселективная ангиография.
По результатам биохимического анализа крови выявляется гиперглобулинемия с нормальным или сниженным уровнем альбумина. Также особое внимание следует уделять функции почек и уровню ионизированного кальция. Гиперкальциемия может развиться в результате прямого остеолиза инфильтративными плазматическими клетками16 или выработки веществ, подобных паратиреоидному гормону (ПТГ), пептида, связанного с паратиреоидным гормоном (PTHrP)17.
Для определения класса иммуноглобулинов и выявления моноклональной гаммапатии используют электрофорез сыворотки, иммуноэлектрофорез и количественный анализ.
На данный момент такое исследование проводит только одна ветеринарная лаборатория – «Шанс Био».
В общем анализе мочи выявляются протеинурия, изостенурия/гипостенурия без активного осадка. Для выявления протеинурии Бенс-Джонса необходимы термопреципитация и электрофорез мочи, а для постановки диагноза – исследование костного мозга. В нормальном костном мозге содержится до 5% плазматических клеток, в то время как в пораженном множественной миеломой костном мозге их содержится гораздо больше.
У животных без остеолитических костных очагов и инфильтрации органов диагноз может быть поставлен на основании плазмоцитоза костного мозга с прогрессирующим повышением уровня М-компонента.
На обзорных рентгенограммах скелета можно определить наличие и распространенность остеолитических очагов. В редких случаях может потребоваться биопсия этих очагов. Чаще всего выявляют поражение позвонков, ребер, костей таза, черепа и проксимальных участков трубчатых костей.
На обзорном УЗИ брюшной полости/КТ-неселективной ангиографии – признаки сплено-/гепатомегалии, гломерулонефрита/структурных изменений почек, лимфаденопатии.
Также необходимо осмотреть глазное дно. Можно выявить ретинальное кровотечение, аневризмы, отслойку сетчатки и слепоту. Кровотечение может быть результатом снижения адгезивности тромбоцитов после покрытия их миеломными белками, перегрузки кровеносных сосудов загустевшей кровью, вызывающей их разрыв, или отложения плазматических клеток в стенке кровеносного сосуда, вызывающего ее ослабление и разрыв18.
При макроглобулинемии плазмоциты чаще инфильтрируют селезенку, печень и лимфоидную ткань, чем кости8.
Диагноз ММ ставится на основании выполнения всех или почти всех перечисленных ниже условий:
- миеломные белки в сыворотке крови или в моче (М-компонент);
- инфильтрация органов злокачественными плазмоцитами;
- плазмоцитоз костного мозга;
- наличие остеолитических костных очагов.
- лимфомы, ХЛЛ, ОЛЛ;
- моноклональная гаммапатия;
- хронические/векторные инфекции (эрлихиоз, ИПК, лейшманиоз, токсоплазмоз, гингивостоматит кошек).
Прогноз при ММ у кошек менее благоприятный. Большинство животных погибают в течение 2–3 месяцев после постановки диагноза из-за непродолжительного ответа на лечение. Есть данные о выживаемости от 6 до 12 месяцев4,8.
Лечение
Цель лечения ММ: снижение количества миеломных клеток, уровня иммуноглобулинов, уменьшение боли в костях, костных очагов.Схемой выбора терапии является комбинация мелфалана (алкилирующий агент) в сочетании с ГКС (преднизолон). Начальная доза мелфалана – 0,1 мг/кг в сутки 10 дней, далее – 0,05 мг/кг постоянно. Преднизолон в дозе 0,5 мг/кг 1 раз в сутки 10 дней, далее – 0,5 мг/кг через день длительно2. Терапию продолжают до клинического рецидива или до развития миелосупрессии (тромбоцитопения), что требует приостановки лечения или снижения дозы.
Контроль клинического анализа крови с ручным подсчетом тромбоцитов рекомендовано проводить 1 раз в 2 недели на протяжении 2 месяцев, далее – 1 раз в месяц.
Также есть альтернативный метод лечения мелфаланом: пульс-терапия – 7 мг/м2 1 раз в сутки, 5 дней подряд в течение 3 недель19.
Другие алкилирующие препараты, включая циклофосфамид, хлорамбуцил и ломустин, также использовались для лечения ММ у мелких домашних животных20-21. Добавление циклофосфамида к схеме приема преднизолона и мелфалана может быть полезным для пациентов с тяжелыми клиническими признаками и/или гиперкальциемией. Благодаря своему тромбоцит-сберегающему эффекту циклофосфамид может применяться вместо мелфалана у пациентов с тромбоцитопенией, хотя этот препарат может оказывать серьезное подавляющее действие на другие линии костного мозга22-25. Хлорамбуцил, вводимый в дозе 0,2 мг/кг 1 раз в день, успешно применялся для лечения макроглобулинемии на основе иммуноглобулина класса М у собак26.
В качестве протокола запаса при рецидиве ММ может быть назначен протокол СНОР (винкристин, циклофосфамид, доксорубицин, преднизолон)27.
Описан случай применения бортезомиба у кошки с ММ28. Из статьи известно, что всего было проведено 6 циклов лечения, причем каждый цикл состоял из подкожного введения препарата 2 раза в неделю в течение 2 недель с последующим 1-недельным отдыхом. Доза бортезомиба составляла 0,7 мг/м2 в течение первой недели и 1,0 мг/м2 в течение второй недели первого цикла. Для последующих циклов использовалась доза 0,7 мг/м2. В течение первых 2 циклов одновременно применялся преднизолон. После лечения бортезомибом клинические симптомы исчезли, было отмечено снижение уровня сывороточного глобулина и восстановление панцитопении. Моноклональная гаммапатия, повышенная продукция легкой цепи сывороточного иммуноглобулина и протеинурия Бенс-Джонса, которые существовали на момент постановки диагноза, не были обнаружены на 123-й день. Моноклональная гаммапатия также не была обнаружена в конце лечения бортезомибом (213-й день). Анорексия, усталость и выраженная токсичность для костного мозга наблюдались при введении бортезомиба в дозе 1,0 мг/м2, в то время как при использовании дозы 0,7 мг/м2 в течение всего периода лечения не наблюдалось никакой токсичности.
На момент написания статьи пациент из описанного ниже клинического случая находился под наблюдением, и на 243-й день не было отмечено признаков рецидива.
Клинический случай
Пациент: 10-летняя кошка Мурена (метис), стерилизованная и ежегодно вакцинируемая, поступила в клинику по направлению из сторонней клиники для проведения КТ-онкопоиска.Владельцы изначально обратились в стороннюю клинику по причине возникновения у питомца признаков гипорексии, анемии и вялости. При перенаправлении пациента из сторонней клиники дифференциальными диагнозами были онкозаболевание и ИПК. Пациенту были назначены эсперавир и преднизолон в дозе 3 мг в сутки, также было рекомендовано проведение КТ-онкопоиска. По результатам клинического и биохимического анализов крови, проведенных в сторонней клинике, были выявлены анемия и гипоальбуминемия.
После осмотра анестезиологом пациент был направлен в терапевтическое отделение с последующим размещением в ОРИТ для стабилизации состояния.
Диагностика. Терапевтом были рекомендованы повторные исследования клинического и биохимического анализов крови, поскольку на приеме была выявлена бледность слизистых оболочек у животного.
По результатам проведенных анализов от 12.05.2024 г. наблюдались нормохромная, нормоцитарная, слаборегенераторная анемия (гематокрит – 16% при норме от 30%, ретикулоциты – 20 тыс/мкл при норме 3–50 тыс/мкл) и умеренная тромбоцитопения (ручной подсчет тромбоцитов) – 72×109/л при норме 151–600×109/л), гипоальбуминемия (19 г/л при норме 25–43 г/л).
На основании полученных результатов было рекомендовано проведение гемотрансфузии с использованием цельной свежей донорской крови по причине наличия тяжелой анемии, тромбоцитопении и гипоальбуминемии. Также для выявления причины анемии было рекомендовано проведение ПЦР на гемотропные микоплазмы (результат отрицательный).
После гемотрансфузии 40 мл ЦК гематокрит поднялся на 2 единицы. Затем была проведена гемотрансфузия ЦК 50 мл, и гематокрит составил 27,3%, тромбоциты при ручном подсчете – 112×109/л, сохранялась гипоальбуминемия – 21,7 г/л.
Затем пациент был направлен на проведение КТ-неселективной ангиографии. Перед анестезиологическим сопровождением также были оценены гематокрит – 27% и альбумин – 22 г/л.
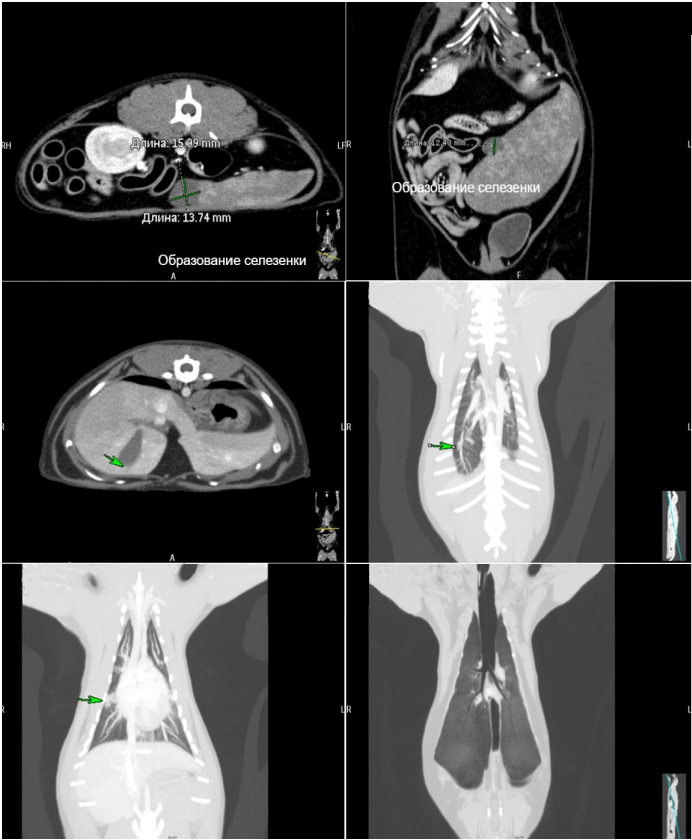
По результатам КТ от 24.05.2024 г.: в вентральном крае селезенки с медиальной поверхности визуализируется гиподенсное образование овоидной формы с бугристыми контурами, неоднородной структурой за счет перегородок и приблизительными размерами – 16×14×12 мм; после проведения внутривенного контрастирования наблюдается гетерогенное накопление контрастного вещества. Паренхима селезенки в месте локализации образования значительно истончена с медиальной поверхности (фото 1).
На основании полученных результатов проведенных исследований дифференциальными диагнозами были лимфома, плазмоцитома, нодулярная гиперплазия селезенки, ОЛЛ, ХЛЛ.
Лечение. Кошка Мурена была направлена в хирургическое отделение для проведения спленэктомии и забора костного мозга. Дополнительно перед операцией было рекомендовано исключить вирусный лейкоз методом ПЦР и вирусный иммунодефицит методом ИФА, а также сдать контрольные предоперационные анализы крови. По результатам анализов – нормохромная, нормоцитарная, слаборегенераторная анемия (гематокрит 27%, ретикулоциты – 14,6 тыс/мкл), тромбоцитопения (ручной подсчет – 109×109/л), гиперглобулинемия – 114,8 г/л (при норме до 50 г/л), гипоальбуминемия – 21,2 г/л.
После операции пациент был направлен в ОРИТ на медикаментозное обезболивание и мониторинг. Результаты послеоперационных анализов крови: гематокрит – 21,1%, нерегенераторная анемия (тромбоциты при ручном подсчете) в норме – 193×109/л, ретикулоциты – 7,3 тыс/мкл). Результат на хронические вирусные инфекции отрицательный.
Спустя 2 дня после оперативного вмешательства пациент был выписан на амбулаторное лечение с последующим контролем результатов анализов крови.
По результатам анализов от 31.05.2024 г. – нормохромная, нормоцитарная, умеренно регенераторная анемия (гематокрит – 26%, ретикулоциты – 32,9 тыс/мкл), гипоальбуминемия – 20,7 г/л. Аппетит у кошки сохранен, проявляет умеренную активность.
По результатам анализов от 05.06.2024 г. – нормохромная, нормоцитарная, умеренно регенераторная анемия (гематокрит – 23,7%, ретикулоциты – 37,1 тыс/мкл), альбумин в норме – 27,4 г/л.
По результатам гистологии селезенки: круглоклеточное новообразование селезенки (плазмоклеточное более вероятно), экстрамедуллярный гемопоэз, гематома инкапсулированная.
Дифференциальный диагноз: некожная экстрамедуллярная плазмоцитома, лимфома (иммуноглобулин-секретирующая); можно использовать иммуногистохимические маркеры – MUM1, PAX5, CD3.
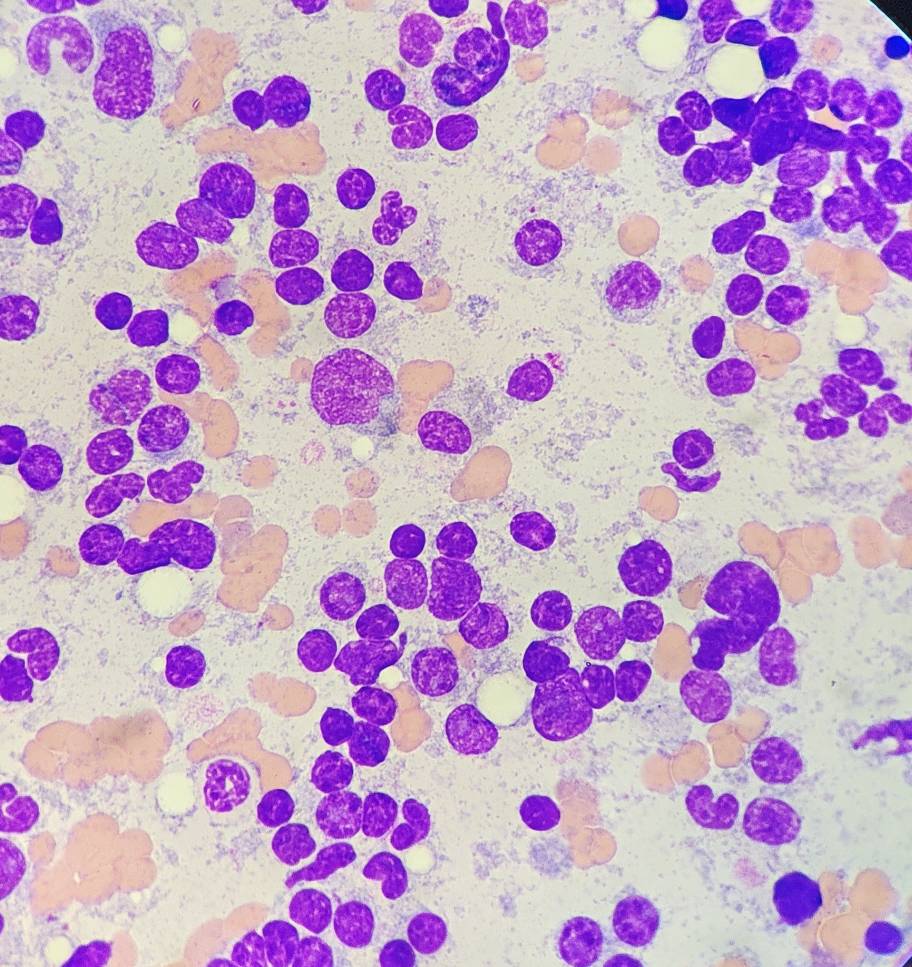
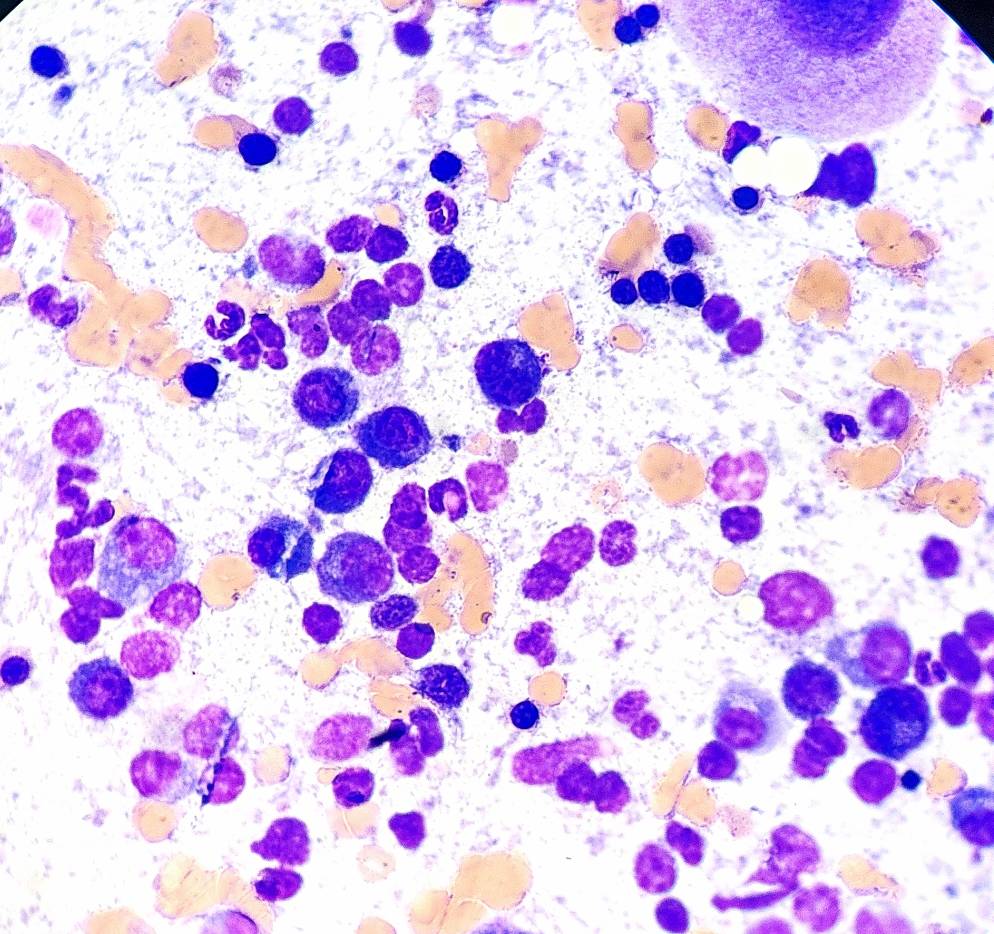
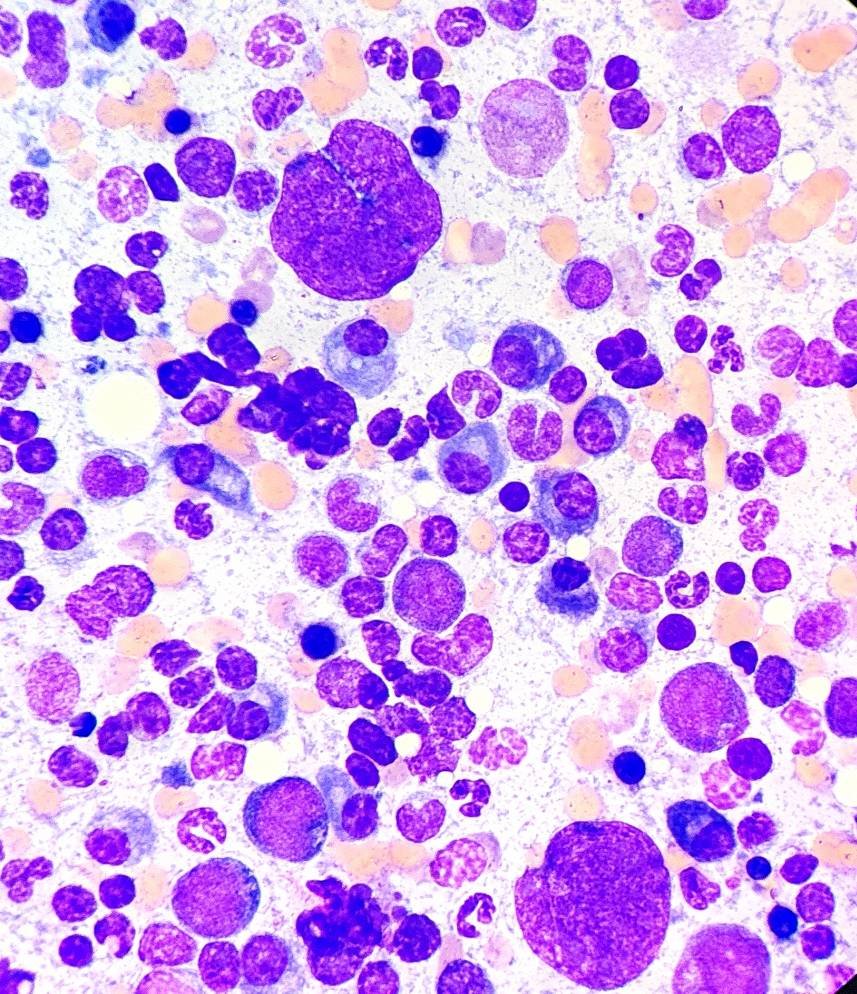
По результатам цитологического исследования костного мозга: соотношение миелоидных клеток к эритроцитарным (М:Э) составляет 1,6 (норма 0,9–1,8). Количество бластов составляет 2,4%. 18% от всех ядерных клеток представлены плазмоцитами, в том числе в скоплениях в островках. Лимфоциты составляют до 6%. Инфекционных агентов не обнаружено. Высокая клеточность, мегакариоцитарная гиперплазия с признаками дисплазии, эритроидный и гранулоцитарный ряд представлены нормой, эозинофильная гиперплазия, плазмоцитарная инфильтрация.
С учетом гиперглобулинемии и круглоклеточного новообразования селезенки наиболее вероятным дифференциальным диагнозом является миеломоподобное заболевание, однако для постановки диагноза необходимы дополнительные исследования (КТ на предмет наличия очагов лизиса в костях, оценка белков Бенс-Джонса в моче, электрофорез белков крови). У кошек очаги инфильтрации зачастую могут возникать не в костном мозге, а поражать селезёнку и печень с последующим метастазированием.
Результаты контрольных анализов крови от 13.06.2024 г.: нормохромная, нормоцитарная, умеренно регенераторная анемия (гематокрит – 26,8%, ретикулоциты – 27,5 тыс/мкл), альбумин – 28,2 г/л, глобулин – 88,8 г/л. Общее состояние в пределах нормы. Аппетит у кошки сохранен, активна.
Было рекомендовано проведение ИГХ для верификации образования селезенки. По результатам ИГХ – морфологическая и иммуногистохимическая картина CD3 положительной плазмоцитомы селезенки.
По результатам цитологии костного мозга, клинической картины и результата гистологического исследования тканей селезенки назначена химиотерапия по протоколу: алкеран (мелфалан) 2 мг – из расчета 0,1 мг/кг 1 раз в день, 10 дней – 1/5 таблетки 1 раз в день, далее 1/10 таблетки 1 раз в день, длительно; преднизолон – 0,5 мг/кг 1 раз в день, 10 дней, далее через день. Также рекомендовано проведение контрольных анализов крови (клинический без лейкоформулы, альбумин и общий белок) спустя 7 дней с момента начала терапии.
Владельцы кошки отказались от проведения химиотерапии, о прогнозах были предупреждены. Общее состояние животного в пределах нормы, на момент написания статьи принимает только преднизолон в дозе 1 мг/кг в качестве паллиативной терапии.
Заключение
Миеломная болезнь у животных представляет собой сложное заболевание, требующее тщательной диагностики и понимания патогенеза по причине схожести симптомов с другими заболеваниями.Гиперглобулинемия характерна для многих патологий, но может сигнализировать о наличии неоплазии (множественная миелома, плазмоцитома, лимфома, хронический лимфолейкоз).
Нерегенераторная анемия, особенно с панцитопенией, является обязательным показанием для забора красного костного мозга (ККМ).
Несмотря на то что этиология миеломы остается частично неизвестной, выявление предрасполагающих факторов и клинических признаков позволяет ветеринарным специалистам более эффективно подходить к лечению.
Список литературы:
- Qurollo B. A., Balakrishnan N., Cannon C. Z., et al. Co-infection with Anaplasma platys, Bartonella henselae, Bartonella koehlerae and ‘Candidatus Mycoplasma haemominutum’ in a cat diagnosed with splenic plasmacytosis and multiple myeloma, J Feline Med Surg, 16: 713–720, 2014.
- Burnett R. C., Blake M. K., Thompson L. J., Avery P. R., Avery A. C. Evolution of a B-cell Lymphoma to Multiple Myeloma after Chemotherapy. J of Vet Intern Med, 18(5): 768–771, 2004.
- Radhakrishnan A., Risbon R. E., Patel R. T., Ruiz B., Clifford C. A. Progression of a Solitary Malignant Cutaneous Plasma Cell Tumor to Multiple Myeloma in a Cat. Veterinary Comparative Oncology, 2(1): 36–42, 2004.
- Hanna F. Multiple Myelomas in Cats. Journal of Feline Medicine and Surgery, 7(5): 275–287, 2005.
- Matus R. E., Leifer C. E., MacEwen E. G. et al. Prognostic factors for multiple myeloma in the dog. J Am Vet Med Assoc, 188(11): 1288–92, Jun 1, 1986.
- Patel R. T., Caceres A., French A. F. et al. Multiple myeloma in 16 cats: a retrospective study. Vet Clin Pathol, 34(4): 341–52, Dec 2005.
- Mellor P. J., Haugland S., Murphy S. et al. Myeloma-related disorders in cats commonly present as extramedullary neoplasms in contrast to myeloma in human patients: 24 cases with clinical follow-up. J Vet Intern Med, 20(6): 1376–83, Nov-Dec 2006.
- Mellor P. J., Haugland S., Smith K. C. et al. Histopathologic, immunohistochemical, and cytologic analysis of feline myelomarelated disorders: further evidence for primary extramedullary development in cat. Vet Pathol, 45(2): 159–73, Mar 2008.
- Jane M. Dobson, B. Duncan X. Lascelles. BSAVA. Manual of Canine and Feline Oncology. 3rd ed., 2011.
- Majzoub M. et al. Histopathologic and immunophenotypic characterization of extramedullary plasmacytomas in nine cats. Vet Pathol, 40(3): 249–53, May 2003.
- Schöniger S. et al. Sinonasal plasmacytoma in a cat. J Vet Diagn Invest, 19(5): 573–7, Sep 2007.
- Tamura Y., Chambers J. K., Neo S., Goto-Koshino Y., Takagi S., et al. Primary duodenal plasmacytoma with associated primary (amyloid light-chain) amyloidosis in a cat. JFMS Open Rep, 6(2), Sep 21, 2020.
- Greenberg M. J. et al. Intracerebral plasma cell tumor in a cat: a case report and literature review. J Vet Intern Med, 18(4): 581–5, Jul-Aug 2004.
- Michau T. M., et al. Intraocular extramedullary plasmacytoma in a cat. Vet Ophthalmol, 6(2): 177–81, Jun 2003.
- Kyriazidou A., Brown P. J., Lucke V. M. Immunohistochemical staining of neoplastic and inflammatory plasma cell lesions in feline tissues. J Comp Pathol, 100(3): 337–41, Apr 1989.
- Sheofor S. E., Gamblin R. M., Couto C. G. Hypercalcaemia in two cats with multiple myeloma. J Am Anim Hosp Assoc, 32(6): 503–8, Nov-Dec 1996.
- Rosol T. J., Capen C. C. Biology of disease mechanisms of cancer-induced hypercalcaemia. Lab Invest, 67(6): 680–702, Dec 1992.
- Hendrix D. V. H., Gelatt K. N., Smith P. J., Brooks D. E., Whittaker C. J. G., Chmielewski N. T. Ophthalmic disease as the presenting complaint in five dogs with multiple myeloma. J Am Anim Hosp Assoc, 34(2): 121–8, Mar-Apr 1998.
- Claire M. Cannon. Clinical Signs, Treatment, and Outcome in Cats with Myeloma-Related Disorder Receiving Systemic Therapy. J Am Anim Hosp Assoc, 51(4): 239–48, Jul-Aug 2015.
- Seelig D. M., Perry J. A., Avery A. C., Avery P. R. Monoclonal Gammopathy without Hyperglobulinemia in 2 Dogs with IgA Secretory Neoplasms. Vet Clin Pathol, 39(4): 447–453, 2010.
- Grogan T. M. Plasma Cell Myeloma Marrow Diagnosis Including Morphologic and Phenotypic Features. Seminars in Diagnostic Pathology, 20(3): 211–215, 2003.
- Burton J. H., Mitchell L., et al. Low-Dose Cyclophosphamide Selectively Decreases Regulatory T Cells and Inhibits Angiogenesis in Dogs with Soft Tissue Sarcoma. J Vet Intern Med, 25(4): 920–926, 2011.
- Sato M., Yamazaki J. et al. Evaluation of Cytoreductive Efficacy of Vincristine, Cyclophosphamide, and Doxorubicin in Dogs with Lymphoma by Measuring the Number of Neoplastic Lymphoid Cells with Real-Time Polymerase Chain Reaction. J Vet Intern Med, 25(2): 285–291, 2011.
- Warry E., Hansen R. J., Gustafson D. L., Lana S. E. Pharmacokinetics of Cyclophosphamide after Oral and Intravenous Administration to Dogs with Lymphoma. J Vet Intern Med, 25(4): 903–908, 2011.
- Mitchell L., Thamm D. H., Biller B. J. Clinical and Immunomodulatory Effects of Toceranib Combined with Low-Dose Cyclophosphamide in Dogs with Cancer. J Vet Intern Med, 26(2): 355–362, 2012.
- Jaillardon L., Fournell-Fleury C. Waldenström’s Macroglobulinemia in a Dog with a Bleeding Diathesis. Vet Clin Pathol, 40(3): 351–355, 2011.
- Fernández R., Chon E. Comparison of two melphalan protocols and evaluation of outcome and prognostic factors in multiple myeloma in dogs. J Vet Intern Med, 32: 1060–69, 2018.
- Tani H., Miyamoto R., Miyazaki T. et al. A feline case of multiple myeloma treated with bortezomib. BMC Vet Res, 18: 384, 2022.

 vetpeterburg
vetpeterburg Ветеринарный Петербург
Ветеринарный Петербург